氢气是氢元素的最简单分子形式,受人类自身知识和各种因素限制,过去人类对氢气的医学生物学效应研究很少,近10年来的大量研究发现氢气具有非常神奇的医学生物学效应,氢气医学效应背后可能隐藏着巨大的秘密。
要全面理解氢气的医学生物学效应,首先必须了解氢气发现的历史、氢气的理化性质和氢元素的特点,这些都是与氢气医学效应关系密切的性质,对于理解和研究氢气的生物学作用机制非常重要。因此,本章将介绍氢元素、氢气的发现历史和氢气的物理、化学性质。
德国著名天体物理学家A.H.G.博尔纳(Albert Hermann Gerhard Boerner)曾经说过:“氢是宇宙中最重要的成分。”宇宙中除暗物质暗能量外,75%以上的有形物质是由结构最简单的氢元素组成的。大部分氢原子是由包含一个质子的原子核和一个核外电子组成。人是自然界最复杂的物质形式,人体主要也是由以氢元素为主的有机碳氢化合物和水分子组成的。
从物理性质角度看,氢气在水中的溶解度非常低,在室温和常压条件下,一升水在溶解度达到饱和状态时大约可以溶解0.8毫摩尔氢气,这一浓度虽然看起来比较低,但这是生物学体系中常见的活性物质浓度范围,也是氢气具有医学生物学效应的剂量前提。氢气是一种化学性质比较稳定的分子,其中最显著的化学性质是还原性。过去的观点认为,氢气直接与其他物质发生反应需要一定的温度和浓度等条件,生物体系中不具备这样的条件,因此认为氢气不具有生物学效应。但是生物体系的反应是在多种酶催化的条件下进行的,例如最近有人发现氢气可以被机体和细胞线粒体代谢,提示氢气与其他物质发生反应是非常可能的。况且不发生或很难发生化学反应也不是产生生物学效应的必要条件,生物体内可能存在我们不了解的能促进氢气与其他物质发生反应的条件,这是氢气发挥生物学效应的化学基础。
1.1 氢——宇宙一号元素
氢(hydrogen)是一种化学元素,在元素周期表中位于第一位,元素符号是H,是自然界最小的原子。有人说世界起源于自然法则,也有人说起源于氢元素。无论怎么说,在宇宙、银河系、太阳、行星、卫星演变以及漫长精彩的各类生命起源和进化过程中,氢元素都无处不在,并一直扮演着重要角色。

2018年3月14日,英国著名理论物理学家斯蒂芬·威廉·霍金(Stephen William Hawking)去世,霍金研究的黑洞和宇宙论对普通人来说实在难以全面理解,我们暂且不去追究他的理论是否完全正确,从历史发展角度看,将来应该有更理想的理论来解释这些现象。目前他的理论是公认比较正确的,阐述宇宙产生的系统学说。
为了清楚阐述量子力学如何影响宇宙的起源和命运,霍金提出了“热大爆炸模型”。这一观点认为,我们的宇宙是起源于150亿年前密度无限大、温度无限高和体积无限小的一个奇点的爆炸。那就是宇宙的起源,也是时间和空间的起源。大爆炸模型假定,从大爆炸开始的那一刻起,宇宙就按照弗里德曼模型演化。所谓弗里德曼模型,是指在宇宙膨胀过程中,宇宙中任何物体都会因为辐射而降低温度。温度是微观粒子平均运动速度的整体或宏观体现,粒子运动速度越快,则宏观温度越高,反之亦然。宇宙降温会对其中的物质状态产生巨大影响。在非常高的温度下,粒子运动得非常快,甚至能逃脱任何核力或电磁力的吸引(此时无法形成原子)。当温度逐渐降低时,互相吸引的核力或电磁力使粒子开始相互结合。更重要的是,存在于宇宙中的粒子种类也依赖于温度高低发生变化。
在大爆炸后的大约100秒,温度从无限大迅速降低到了10亿摄氏度。在此温度下,质子和中子不再有足够的能量逃脱粒子之间强核力的相互吸引,开始结合产生氛(重氢)的原子核。氟核包含一个质子和一个中子,所以宇宙演化过程中出现的第一类原子核就是氟核。然后尔核与更多质子、中子相结合形成氨核,它包含两个质子和两个中子,还产生了少量的两种更重的元素锂和皱。余下的中子会衰变成质子和电子,质子不需要与任何粒子结合,本身就是气原子的核,也是我们所熟悉的氢离子。也就是说,在原子形成过程中,先有重氢原子核,然后有气原子核;先形成原子核,后来才出现原子。
大爆炸后的4分钟,氨和其他元素原子核的产生就基本停止了。从宏观上考虑,此后30万年左右,宇宙仅仅只是继续膨胀,没有发生什么颠覆性的变化。最后,一旦温度降低到几千摄氏度,电子和核子不再有足够能量去抵抗它们之间的电磁吸引力,开始结合形成原子。在大爆炸发生30万年后,质子与电子结合,宇宙中最伟大最重要的成员氢原子诞生了。
随着时间流逝,星系中的氢气和氨气被分割成更小的星云,它们在自身引力下坍缩。它们收缩时原子互相碰撞,气体温度不断升高,到一定程度后,热得足以开始发生热核聚变反应。这些反应将更多的氢转变成氨,释放的热升高了压强,使星云不再继续收缩。如同太阳一样,它们将氢燃烧成氨,并将得到的能量以热和光的形式辐射出来。它们会稳定地在这种状态下停留一段很长的时间。质量更大的恒星需要变得更热,以平衡它们更强的自身引力,它们的核聚变反应进行得极快,以至于它们在一亿年这么短的时间里,就将全部氢消耗完,并给生命进化的行星提供光和热。
无论我们现在的宇宙是不是真如上述所描述的样子形成,科学观测表明,组成宇宙的成分中,90%是氢元素,9%是氨元素。我们生活的地球的成分组成与此不同,地壳中各主要元素的含量从高到低依次为氧、硅、铝、铁、钙、钠、钾、镁、氢,成分百分比分别为:氧48.06%、硅26.30%、铝7.73%、铁4.75%、钙3.45%、钠2.74%、钾2.47%、镁2.00%、氢0.76%。不过像地球这样的星球,并不是宇宙的主要成分。太阳这样分量更大的恒星才是宇宙的主要成员,是决定宇宙成分的主要因素。
博尔纳认为,“氢是宇宙中最重要的成分”。氢是宇宙元素的观点,可以从含量、结构和功能三个方面来说明。第一,氢元素是宇宙的基本成分和最主要成分,在宇宙所有元素中占90%,其他元素也都是由氢元素演变而成。第二,氢元素是结构最简单的元素。第三,氢元素是宇宙中各类能量转化的枢纽,氢元素聚变是太阳等恒星产热的基础,生物能量转化也是以传递氢原子的方式进行。
出华盛顿大学物理学教授约翰·里格登(John Rigden)写了一部关于氢的著名科普书《氢的传奇》,2002年该书被《发现》杂志选为最佳科普著作。里格登这样评价氢,“我们对物质世界的认识,小到最基本原子,大到宇宙本身,都可以由氢贯穿起来”。在这本书中,里格登给我们展示了氢在科学发展历史中的独特魅力,氢原子结构最简单,也最为独特,数百年来,氢元素一直吸引着世界顶级科学家的兴趣和关注。
德国科学家在《自然》杂志的研究报道,从遗传角度再次确认,地球生命始祖是一种依靠氢气为能量的微生物。这一发现与过去通过地质学研究和海底微生物研究获得的结论类似,进一步确定了祖先生物的特征。过去科学家根据生命起源的地球环境,曾经推测原始生命是依靠氢气为能源的观点。对许多地球深部岩石的勘探也证明,在生命起源的地质年代,空气和水中都含有大量氢气。最近大量证据表明,作为所有真核细胞能量代谢的核心细胞器,线粒体就是进化自能制造氢气的原始变形菌。生物信息学研究表明,细菌代谢氢气的氢化酶和真核细胞线粒体电子传递链的复合物I功能亚基属于同源分子,提示氢气可能会影响细胞能量代谢的核心过程。总之,从基因到表型,从环境进化到能量代谢,从理论到实际证据,都说明氢气是生命诞生的必要条件。
氢气作为生命能源的基本供体,对许多生物分子和生物化学过程产生调节和影响,几乎就是一种必然。最近大量医学研究发现,氢气对人和动物疾病有预防作用,还可以调节植物和微生物的生长,防护植物疾病损伤。这些证据都提示氢气这种生命气体分子仍然具有产生巨大生物活性的潜力,这非常符合逻辑和预期,可以认为氢气是生命之父。
笔者认为,氢元素就是为科学而生,围绕氢气的研究就是一部自然科学传奇。氢气现在进入医学生物学家的视野,又将在生物医学领域演绎传奇。巧合的是,有机生命组成最多的元素也是氢,作为电子传递介质,氢元素也是生命能量转化的中心成员,而生命内环境最重要的成分水主要也是由氢元素组成。因此可以说,氢元素不仅是宇宙元素,也是生命元素。
1.2 氢元素和氢气
氢是唯一由几种同位素共同组成的物质元素。自然界中存在的氢同位素有氕(protium)、氘(deuterium)和氚(tritium)三种。以人工方法合成的同位素还有“H、5H、6H和H等。氕是自然界中含量最多的氢同位素,丰度达99.98%,气原子核只有一个质子,不含中子,是构造最简单的原子(见图1-1)。

图1-1 氢原子的波尔模型
氘是含量第二的氢同位素,在海水中氛的浓度大约是155ppm①,氘氢键能产生更强的蒸发分离效应,在高原极地冰中氘的含量是140ppm左右。虽然氘的含量比较少,但由于氢同位素效应是所有元素中最显著的,氘的生物学效应也受到学者关注。有概念认为冰川水和低氘水是功能水,低氘水支持者认为,氢键影响生命体所有反应和结构构成,是水、蛋白质和核酸等重要生物分子结构形成的最基本化学形式。由于同位素效应,氘形成的氢键键能比氕高,生物体系内氘比例改变必然对生物过程产生影响。1974年,T.R.格里菲思(T.R.Griffiths)根据氛的同位素效应,还有氘水对许多生物的毒性作用等现象,提出氘加速衰老、影响DNA反应酶活性的假说。此后一些学者开始对低氘水生物效应进行研究。其中比较著名的是匈牙利生物学家G.索姆利艾(Gabor Somylai)博士,他发现低氘水能显著抑制肿瘤细胞的分裂繁殖。索姆利艾博士用低氘水对癌症、糖尿病等疾病进行临床研究,发现低氘水具有一定抗癌和抗糖尿病效果。目前低氘水生物医学研究总体规模非常小,尚没有得到主流医学的认可。
作为最简单的原子,氢在原子物理领域有特别的理论研究价值。众多科学家对氢原子的光谱、能级、成键等方面不断深入研究,对量子力学和生命科学领域的人类革命性发现起到了十分关键的作用。
根据核外电子的不同,氢原子有氢阴离子、氢阳离子和氢原子三种存在方式。在氢离子化合物中,氢原子得到一个电子成为氢阴离子(以H表示,也称为氢负离子),它与金属等共同构成氢化物(如氢化钙、氢化镁等)。氢阴离子由两个电子及一个质子组成,是已知的除电子盐外体积最小的阴离子。氢阴离子不能在水溶液中稳定存在,是已知最强的碱之一。氢阴离子也是非常强的还原剂,有人利用氢阴离子具有强还原性的特点制备功能食品,笔者认为这种氢阴离子在体内可与氢阳离子反应产生氢气发挥作用,可以归类为氢气医学健康产品。
氢原子失去一个电子成为氢阳离子(以H+表示,简称氢离子)。由于氢阴离子不常用,氢阳离子一般直接称为氢离子。在水溶液和水中,氢离子并不独立存在,而是与水结合存在的。氢离子在酸碱化学中尤为重要,酸碱反应中常存在氢离子的交换。pH值亦称为酸碱值,指的是氢离子或质子的浓度指数,是溶液中氢离子活度的一种标度,也是通常意义上溶液酸碱程度的衡量标准。由于许多生命活动对酸碱度有非常严格的适应范围,例如人的血液pH值必须维持在7.35~7.45。近年来生物学研究发现,氢离子本身就是一种可以启动细胞膜通道的重要信号介质。
共价氢化物是非金属、类金属及一些电正性不大的金属元素与氢形成的化合物。有些元素还可形成双核及多核的氢化物,如H3N和H2O2等,其中以碳形成的氢化物最多。所有有机物都是碳的共价氢化物,有机物是构成生物体结构的最主要成分。
氢原子与电负性大的原子X(如氟、氧和氮等)以共价键结合,若与其他电负性大的原子Y接近,在X与Y之间以氢为媒介,生成X一H.…Y形式的键称为氢键。氢键是一种特殊的分子内和分子间作用力,是实现水的物理化学性质和许多生物大分子功能的重要基础。
氢键是一种比分子间作用力强,比共价键和离子键弱的化学结构,其稳定性介于共价键和离子键之间。在生物体中,大量氢键共同起到稳定结构的作用。例如蛋白质a螺旋是N-H…O型氢键,DNA双螺旋是N-H…O和N-H·N型氢键。水和其他溶媒的异质性是由于在水分子间生成O-HO型氢键(见图1-2)。由于键能较低,氢键的形成和破坏都比较容易,所以氢键对生物分子间的识别与生物化学反应都有着非常重要的意义。
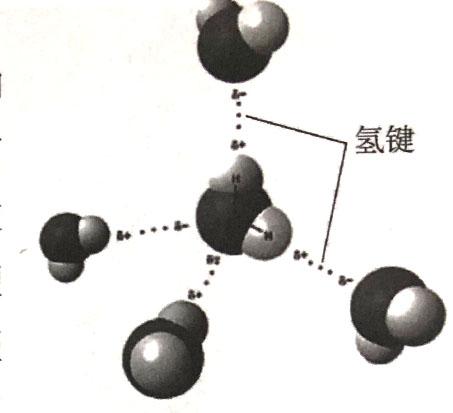
图1-2 水分子之间的氢键(白色为水分子中的氢原子,灰色为氧原子)
①ppm表示百万分之一,1ppm=1×10-6,行业惯用。
1.3 氢气的发现及物理化学性质
1.3.1 氢气的发现
很难根据化学元素的发现历史去确定氢气是谁发现的,因为曾经有很多人尝试通过实验制取氢气。16世纪末期,瑞士化学家帕拉塞尔苏斯(Paracelsus)注意到一个现象,酸腐蚀金属时会产生一种可以燃烧的气体,也就是说他无意中发现了氢气。1671年,爱尔兰著名哲学家、化学家、物理学家和发明家罗伯特·玻意耳(Robert Boyle)也曾经收集氢气并描述了氢气性质,但未进行研究。17世纪时,比利时生化学鼻祖范·海尔蒙特(van Helmont)曾偶然接触过这种气体,但没有把它离析、收集起来。1700年,法国药剂师尼古拉斯·勒梅里(Nicolas Lemery)在巴黎科学院的《报告》上也提到过它。科学发现成果归属于谁,主要取决于科学发现本身的定义和价值。在科学史上,人们最终把氢气的发现者确定为亨利·卡文迪什(Henry Cavendish)(见图1-3),因为是卡文迪什最先把氢气收集起来,并仔细研究确定了氢气的密度等基本物理化学性质。

图1-3 英国剑桥大学著名物理学家和化学家卡文迪什,1731年10年10日出生于法国尼斯,1810年2月24日卒于英国伦敦。以发现氢气和准确测定地球密度闻名
1766年,卡文迪什把一篇名为《论人工空气》的研究报告提交给英国皇家学会。在这一论文中所论及的除碳酸气外,主要讲的就是氢气。卡文迪什用铁、锌等与盐酸及稀硫酸反应的方法制取氢气,并将氢气用水银槽法收集起来。他发现,用一定量的某种金属与足量的各种酸反应,所产生的氢气量总是固定不变的,与酸的种类和浓度无关。他还发现,氢气与空气混合点燃会发生爆炸。所以卡文迪什称这种气体为“可燃空气”。并指出,这种气体是普通空气重量的1/11,不溶于水或碱溶液。
1781年,英国化学家约瑟夫·普里斯特利(Joseph Priestley)发现,“可燃空气”与空气混合爆炸后有液体产生。普里斯特利把这一发现告诉了卡文迪什,卡文迪什用多种不同比例的氢与空气的混合物进行实验,证实了普里斯特利的发现,并断定所生成的液体是水。卡文迪什还发现,把氢气和氧气放在一个玻璃球里再通上电,就可以生成水。后来卡文迪什用纯氧代替空气重复实验,不仅证明氢气与氧气化合成水,而且定量确认大约2体积氢气与1体积氧气恰好化合成水,该结果发表于1784年。尽管卡文迪什首先发现了氢气并证明氢气和氧气反应的定量关系,但由于受到传统燃素学说的束缚,他并没有正确认识到氢气发现的重要价值。
法国著名化学家安托万-洛朗·德·拉瓦锡(Antoine-Laurent deLavoisier)是最早命名氢,也是最早研究氢气生理作用的科学家。他重复了卡文迪什的实验并提出正确的结论一—水是氢和氧的化合物,彻底否定了水是一个元素的传统看法。拉瓦锡于1787年确认氢是一种元素,由于氢气和氧气化合可以产生水,拉瓦锡用拉丁文Hydro为词根,命名氢气为Hydrogen,意思是“成水元素”。日文和朝鲜语中氢气用“水素”的直译来表示,所以市场上“水素水”的本意就是氢水。
中国人知道氢气的概念得益于中国近代化学启蒙者、清代江苏无锡人徐寿(见图1-4)。1868年起,徐寿在江南制造总局下属的翻译馆从事翻译工作,与英国传教士亚历山大·卫礼(Alexander Wylie)、约翰·傅兰雅(John Fryer)等共同致力于将西方近代化学知识体系引入中国,在17年间翻译出版科技著作13部,包括《化学鉴原》《化学鉴原续编》等西方近代化学著作6部63卷。当时许多化学元素没有中文对应,徐寿在翻译过程中发明了音译命名方法,首创了一套化学元素的中文名称。把化学元素英文读音中的第一音节译成汉字作为汉字名称。

图1-4 中国清末著名科学家徐寿,1818年2月16日生于江苏无锡,1884年9月24日卒于上海。中国近代化学先驱,制订了化学元素中文命名规则
对于金、银、铜、铁、锡、硫、碳等元素,从已有中国字里面选最接近含义的字,而钠、钙、镍、锌、锰、钻、镁等,则是通过造新字命名。徐寿认为氧气(oxygen)是人类生存离不开的气体,所以把氧气命名为“养气”,即“养气之质”。氢气(hydrogen)这种气体因为密度超轻,将其命名为“轻气”,后来历经多次文字改革,“氧”代替了“养”,“氢”代替了“轻”,这是中文“氢气”名字的由来。我国化学界给它定名为氢,一方面是由于它的单质是气体,故从气字偏旁;另一方面因为它是自然界最小的分子,质量最轻,所以取它的谐音。
1.3.2 氢气的物理性质
氢通常的单质形态是氢气,氢气是无色、无味和无臭的双原子气体分子。氢气的密度非常小,是自然界相对分子质量最小的气体,比空气的密度小许多。在温度为0℃、压强为101.325千帕的标准状况下,1升氢气质量是0.089克。与同体积的空气相比,氢气质量约是空气的1/14。利用这一性质,人们曾经用氢气球作为空中运输工具。由于氢气的密度非常低,地球表面的氢气不断在大气中上升并逐渐向宇宙中挥发,这是地表空气中的氢气含量非常低的主要原因。在地球表面的大气中只存在极稀少的游离状态氢气,约占总体积的千万分之五(0.5ppm),但是离地面20~25千米的高空大气可能主要由氨和氢两种气体组成。

氢气是非常难液化的气体,在101.325千帕下,氢气在一252.8℃时,能变成无色液体,液体氢具有超导性质。在一259.2℃时,液体氢能变为雪花状固体氢。80多年前,科学家推测氢气在极端高压下可变成金属状态,氢金属也具有超导性质,2017年美国哈佛大学实现了这一目标,利用人工钻石和超高压制造出金属氢。
在一定温度和压强下,气体在一定量溶剂中溶解的最高量称为气体的溶解度。气体的溶解度除与气体本身和溶剂性质有关外,还与温度、压强有关,一般气体溶解度随着温度升高而减少,随压强增大而显著增大。常用某一确定温度条件下,1体积溶剂中所溶解的最多体积数来表示溶解度。氢气在水和许多其他液体中的溶解度比较小。在20℃、1个大气压(纯氢气环境)条件下,100毫升水中能溶解1.82毫升氢气,因此,溶解度表示为1.82%。
按照摩尔浓度计算,20℃时水中溶解1个大气压纯氢气的浓度为0.8毫摩尔/升。也有研究提示,与许多其他气体不同的是,氢气的溶解度可能随着温度的升高而增大。
商品化氢水浓度经常用ppm或ppb来表示,这并不是标准的学术计量单位。ppm是parts per million的缩写,表示百万分之一。1ppm就是每100万克水中含有1克氢气。同样,ppb是parts per bilion的缩写,表示十亿分之一。在饱和状态下每1升水大约溶解18毫升氢气,1升水的质量是1000克,18毫升氢气是1.6毫克氢气。1.6/(1000×1000)=1.6ppm,也就是说饱和氢水的氢气浓度大约是1.6ppm或1600ppb,目前国内的氢产业将毫克/升(mg/L)作为氢水浓度的标准计量单位,1mg/L=1ppm。
1803年,英国化学家威廉·亨利(Willam Henry)根据自己的研究结果总结出一条气体溶解于液体的经验定律,称为亨利定律(Henry's law)。享利定律是指在一定的温度和压强下,气体在液体中的溶解量与该气体的平衡压强成正比。也就是说,气体在液体中的溶解量随着该气体的分压增大而成比例增大。在同样条件下,100%浓度氢气在液体中的溶解量是2%浓度氢气的50倍。常温条件下,氢气在水中的溶解度为1.8%,在脂肪中的溶解度是水中的2倍,为3.6%。氢气在水和脂肪中的溶解度差异会导致氢气进入机体后,大脑等器官的氢气含量高于其他含水量比较高的器官。氢气在镍、钯和钼等一些金属中的溶解度非常大,如一体积钯能溶解几百体积氢气,人们利用氢气的这一物理性质开发出了固体储氢材料。
氢气的比热容大、导热性能好。氢气的导热率比空气大7倍。在相同的压强下,氢的比热容是氮的13.6倍、氨的2.72倍。相对于其他气体,氢的吸热和导热性能都比较强。利用这个特点,可利用热导检测器测定氢气在混合气体中的浓度。
氢气相对分子质量小且没有极性,渗透性很强,常温下就可穿透橡皮和乳胶材料(如给玩具氢气球充气,由于氢气能钻过橡胶上的极小细孔,一段时间后,气球会因为漏气而导致体积缩小,无法升空),在高温下还可透过钯、镍、钢等金属薄膜。在高温和高压下,氢气甚至可以穿过很厚的钢板。钢结构物品暴露于一定温度和压强的氢气中时,渗透于钢晶格中的原子氢在缓慢变形中可导致钢材脆化。氢气渗透能力强的性质给氢气的储存和运输带来很大困难,也给包装氢水等产品维持氢浓度带来一定困难,如常见的PVC材料包装瓶就无法阻止氢气从瓶中逃逸,氢水中溶解的氢气数日就可穿透材料缓慢释放到空气中,目前已知只有铝合金材料可以有效防止氢气逃逸。
氢气扩散速度快。根据气体扩散定律,气体在液体中的扩散速度与该气体相对分子质量的平方根成反比。在液体或人体组织中,氢的扩散速度是氮的3.74倍、氦的1.41倍。对氢气医学来说,氢气的扩散能力强大意味着能进入身体内所有部位。研究表明,氢气非常容易跨越血脑屏障,进入细胞内线粒体和细胞核等部位,也能进入蛋白质、脂肪和核酸等生物大分子内部。扩散速度快是氢气发挥生物学效应的重要基础。
氢气传声速度快。在标准状况下,空气的传声速度是331米每秒,氨的传声速度是972米每秒,而氢的传声速度是1286米每秒。因此,人如果吸入氢气,则语音会发生明显的改变,潜水员呼吸高压氢气和氧气的混合气体也可以发生语音的改变。
1.3.3 氢气的化学性质
氢气在常温下化学性质稳定,稳定的化学性质主要取决于组成氢气的两个氢原子之间较强的共价键。
氢气具有可燃性。在点燃或加热的条件下,氢气可与氧气等氧化物发生化学反应。纯净的氢气在空气或者氧气环境中点燃后可安静燃烧,产生淡蓝色火焰,放出热量并生成水。若在火焰上罩一干冷的烧杯,可在烧杯壁上见到水珠。氢气在空气中发生燃烧或爆炸的浓度范围为4%~74%,在氧气环境中发生燃烧爆炸的浓度范围为4%~94%。氢气在低于4%或超过94%的浓度条件下,即使有火花存在或者在高压条件下,也不会发生燃烧或爆炸。人们利用氢气的这个特点,研发设计呼吸高压氢气的设备用于潜水作业。1975年,美国学者在利用高压氢气改善癌症的研究中,给动物吸入8个大气压97.5%氢气、2.5%氧气(相当于常压环境的20%浓度,可以保证动物正常呼吸)的混合气体就是根据这个道理。
氢气具有还原性,可燃性也是氢气具有还原性的体现,是氢气还原氧气的性质所决定的。氢气不但能与氧单质反应,也能与某些化合物里的氧发生反应。例如氢气通过灼热的氧化铜,可得到红色的金属铜,同时有水生成。在这个反应里,氢气夺取了氧化铜中的氧,生成了水;氧化铜失去了氧,被还原成红色的铜,这个化学实验经常用于证明氢气具有还原性。氢气还能还原其他金属氧化物,如四氧化三铁和氧化锌等。
氢气具有可燃性,氢气与氧气发生燃烧化合反应需要氢气浓度为4%以上,燃点为400℃。人的体核温度只有37℃左右,距离氢气与氧气发生燃烧化合反应的条件非常远。因此认为氢气与氧气在人体内无法发生化学反应,这是长期以来把氢气作为生理学惰性气体的重要原因。但是,不能简单用化学性质来理解生物化学反应,生命体内的生化反应需要大量蛋白酶的催化,并经过多种步骤来实现。人类等哺乳动物肠道内以及土壤里的多种细菌都能合成氢气并代谢利用氢气(如产甲烷菌可以利用氢气和二氧化碳合成甲烷),氢气产生和代谢的过程时刻发生在人类肠道微生物中。一些低等动物和植物也具有这样的能力。生物制氢气也是氢能源领域的重要研究方向,蓝藻等细菌在光照情况下的光合制氢作用可为人类提供大量能源用氢气。因此,氢气绝对是一种典型的生物气体分子,其地位不低于氧气、二氧化碳、一氧化氮等重要生物分子。
氢气不仅具有还原性,也具有氧化性。氢气是由氢原子共价形成的双原子分子,每个氢原子都可以单独获得一个电子形成氢负离子,这种情况见于氢气在高温高压下与强还原性金属发生的反应,此时氢气的作用类似于氧气,氢气属于氧化剂,可把金属氧化为金属离子。氢气与金属反应的产物为金属氢化物,金属氢化物具有极强还原性,非常容易与水发生反应释放大量氢气。某些金属氢化物可以作为储存氢气的理想材料,有人利用氢化钙和氢化镁为原料开发了一系列的氢气功能食品。