之前简单介绍了氢化酶。氢化酶催化氢分子(H2)、质子(H+)和电子(e)的可逆转化,其中的电子无法独立存在,它们必须是原子或分子的一部分,这决定了氢化酶除了具有催化H2可逆转化的活性位点,还应该具有提供电子或接受电子的模块。实际上,不同种类的氢化酶主要是由不同模块如搭积木般进行组合。
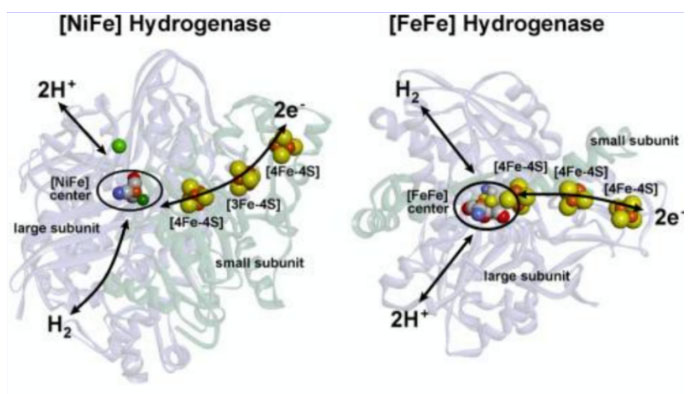
[NiFe]和[FeFe]氢化酶的结构。Lubitz Wolfgang,2014
复合物Ⅰ(NADH:泛醌氧化还原酶,EC 1.6993)在线粒体以及细菌的呼吸链中广泛存在,与氢化酶有天然的联系,是细胞内能量转换网络的重要组成部分。对复合物Ⅰ的解析将有助于对细胞能量代谢的理解。
细胞的能量工厂:线粒体
线粒体(mitochondrion)是高等生物细胞的能量工厂,正常细胞生存所需能量的90%以上由线粒体呼吸链提供。线粒体由两层膜包被,由外至内可划分为线粒体外膜、膜间隙、内膜和基质四个功能区。
线粒体外膜较光滑,通透性较高;线粒体内膜则向内皱褶形成线粒体嵴,通透性低,线粒体嵴的存在增大了内膜的表面积,内膜含有超过150种蛋白质,呼吸电子传递链的酶系都在内膜上。这两层膜将线粒体分出两个区室,位于两层线粒体膜之间的是线粒体膜间隙,被线粒体内膜包裹的是线粒体基质。
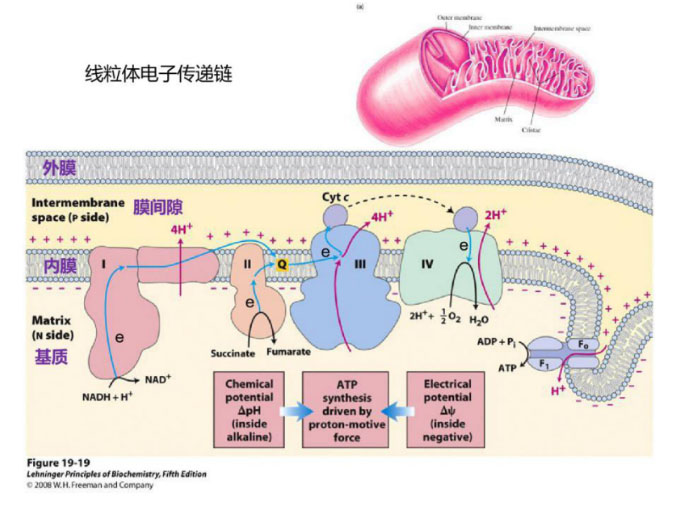
真核生物线粒体的电子传递链是能量代谢的核心部位,线粒体内膜上的5个复合体(复合物Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ)组成线粒体呼吸电子传递链(respiratory electron-transport chain,ETC)。葡萄糖等代谢产生的具有还原性的NADH等分子,通过呼吸链复合物I/II→III→IV的顺序将电子传递给氧气生成水;同时将质子泵出到线粒体膜间隙,线粒体内膜两侧便建立起了电化学梯度,这个电化学梯度有两个组成部分:膜电位(H+带正电荷)和pH梯度(H+也决定酸度)。
哺乳动物线粒体的膜电位约在180 mV左右,pH梯度约为一个单位(相当于60 mV),其总能量约为240mV。一个跨越5nm质膜的60mV电位,相当于在1cm膜上施加120000 V的电位,这是相当高的!当H+通过嵌在内膜的ATP合成酶(呼吸链复合物V,F0F1 ATPase)这个“分子马达”回到线粒体基质时,可以驱动通用能量货币ATP的合成(Chen L B ,1988);膜有一定的通透性,质子跨膜的渗透也是生物系统产热的重要来源。
线粒体跨生物膜的电化学梯度是生物系统进化出的用于储存多余的氧化还原能量的机制,也称为化学渗透机制,这成为细胞重要的能量来源,对细胞的生理功能有重要的影响。在如何将化学能转换为生物能方面,生物系统非常精妙,单个化学反应的能量不好控制,但是当化学能转换成跨生物膜的电化学梯度,膜电位的控制弹性就大多了,电位本身的高低既可以可以调节电子传递速率,也可以调节ATP的产生和产热等。我们在细胞研究中经常要测定线粒体膜电位,就是对细胞的能量状况和线粒体的功能的分析。除了线粒体,细胞膜也是不对称的,在细胞膜两侧也存在电位差,细胞膜上有质子、钠离子、钾离子和钙离子等离子通道,对细胞的功能具有非常重要的调节作用。
复合物 Ⅰ 和氢化酶
线粒体复合物Ⅰ(NADH:泛醌氧化还原酶)是线粒体电子传递链的第一个酶,复合物Ⅰ催化负氢离子从NADH转移到FMN,其中两个电子通过复合物I的系列FeS簇到达N2铁硫簇。电子从N2转移到辅酶Q(也称泛醌)形成QH2,QH2传递电子到复合物Ⅲ,它本身被氧化为Q,Q可以重新循环利用。复合物 Ⅰ 每次传递电子的同时可偶联将4个质子从线粒体内膜基质侧泵到内膜胞质侧的膜间隙。
NADH在细胞内通常作为电子和氢的可溶性载体。细胞内的很多脱氢反应在线粒体中进行,葡萄糖代谢和脂代谢等的中间物在脱氢酶的催化下发生脱氢反应,催化NAD+接受一个负氢离子(一个质子和两个电子)形成还原型NADH。
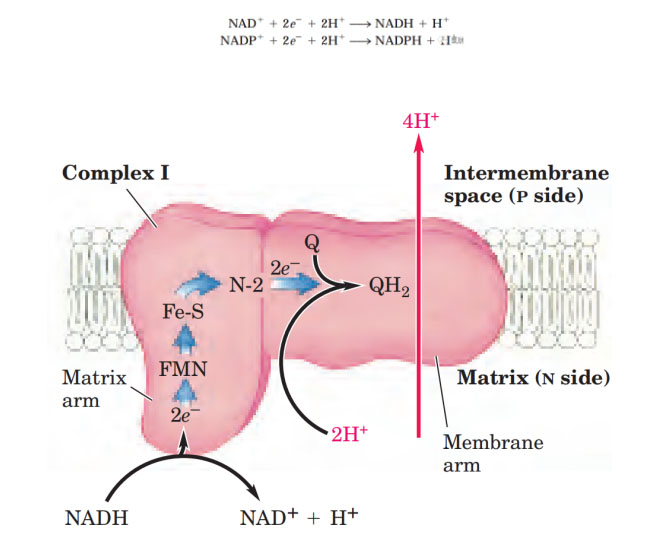
复合物I示意图。Lehninger Principles of Biochemistry
线粒体复合物 Ⅰ 有很多同源酶存在,它们是一类结合在膜上的氧化还原酶家族。如在微生物中广泛存在的产氢的膜结合氢化酶(Hydrogen gas-evolving membrane-bound hydrogenase,MBH)和醌还原复合物I(quinone-reducing complex I),它们是具有共同祖先的同源呼吸复合物,从细菌到人类均高度保守。
复合物Ⅰ(NADH:泛醌氧化还原酶)的核心是由14个保守的“核心”亚单位组成的L型复合物,7个亲水亚单位在线粒体基质侧,7个疏水亚单位位于内膜内。核心亚基根据功能可以分成三个模块:NADH脱氢酶模块(N-module,NuoE、NuoF和NuoG亚基)、醌模块(Q-module,NuoC、NuoI、NuoB和NuoD亚基)和质子泵模块(P-module, NuoA, H, J, K, L, M 和N亚基)(图)。这些亚基从原核生物的细胞膜到真核生物的线粒体都是保守的,真核生物的线粒体复合物 Ⅰ 还含有31个额外的辅助亚基。
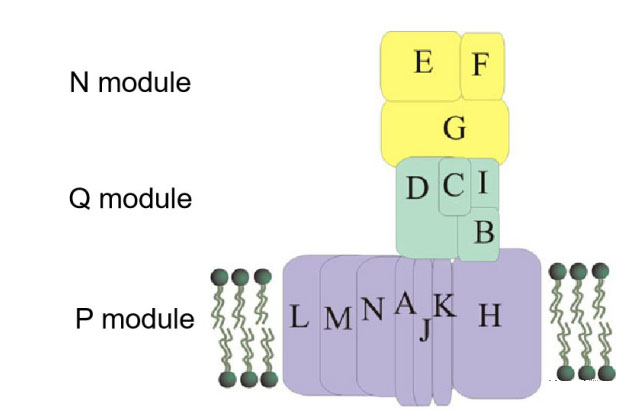
复合物 I 模式图,Moparthi V K,2011
N模块的E和F亚基含有FMN和FeS簇,具有NADH脱氢酶活性,可以从NADH获得电子;G亚基与[Fe]氢化酶类似,含有可以传递电子的FeS簇。
Q模块接受自来自N模块的电子,并经FeS簇将电子传给辅酶Q,I亚基与铁氧还蛋白相似,B和D亚基分别与可溶性[NiFe]氢化酶的小亚基和大亚基相似。值得关注的是,复合物I中的辅酶Q结合位点与D亚基氢化酶中的[NiFe]活性位点相对应。
P模块也称质子易位模块。L、M和N亚基都与H+/Na+逆向转运体(Mrp H+/Na+ antiporter)中的蛋白质亚基同源,如MrpA与L同源,MrpD与 M和N同源, MrpC与K同源,表明KLM亚基可能是被招募到复合物I的。跨膜的H+/Na+逆向转运具有重要的生物学功能,之后会介绍我们在这方面的研究线索。
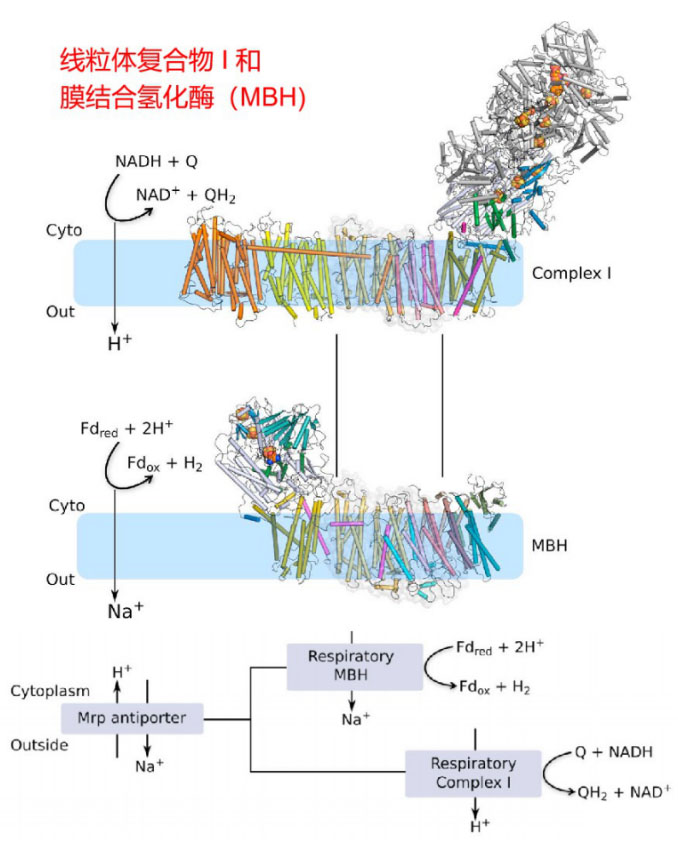
Hongjun Yu, et al. Cell. 2018
目前的研究认为,复合物 I 是由较小的功能模块组合演变而来。进一步的基因组序列分析发现,Q和P模块的11个亚基更为普遍,N模块则作为电子输入模块(Moparthi V K,2011)。据此重新将复合物I按比较小的酶作为功能模块拆分可以分为三个模块:氢化酶模块、转运模块、电子输入模块。氢化酶模块包括了Q模块和P模块的NuoH在内的两个膜蛋白,与存在于许多厌氧或兼性厌氧微生物中的能量转换氢化酶(Energy-converting hydrogenase, Ech)和Hyc类似,在NuoD上含有[NiFe]氢化酶的活性位点。N-模块则作为添加到复合物I的电子输入模块,通过对NADH的氧化连接线粒体的TCA循环和有氧电子传递链。电子输入模块也可以有其他形式,如F420脱氢酶模块(FpoF),甲酸脱氢酶模块(NuoG),硫氧还蛋白(Fd)等。
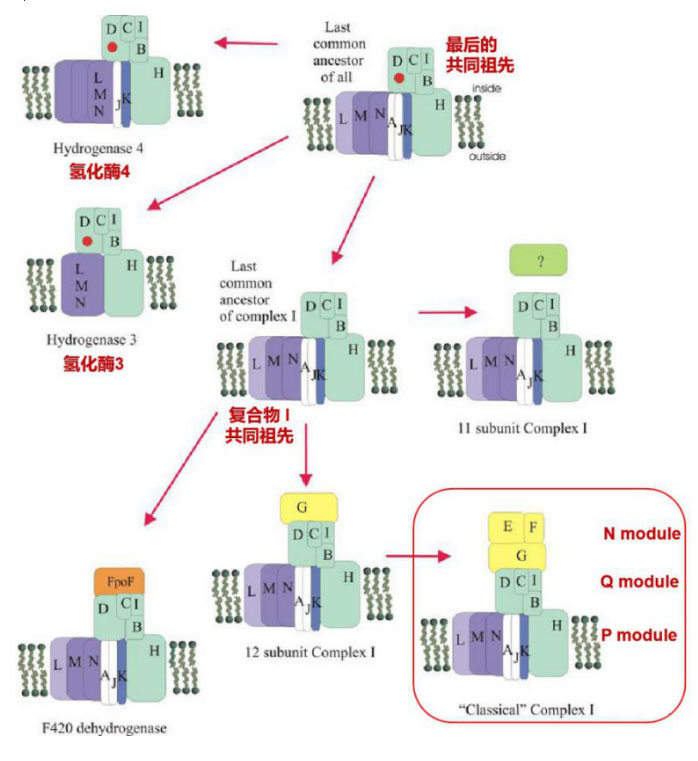
复合物 I 和膜结合氢化酶进化示意图。镍铁活性部位用圆圈表示
Moparthi V K,2011
复合物 I 和膜结合氢化酶进化关系表明,复合物 I 的11核心亚单位是膜结合[NiFe]氢化酶以及目前所有类型复合物I的最后一个共同祖先,在进化过程中,一些酶仍然是氢化酶,但是逐渐退化和丢失了一些组分,或有的亚基的功能变得专一化,如NuoL,M和N的同源蛋白H+/Na+逆向转运体(Mrp H+/Na+ antiporter)。有些酶获得永久性的电子供体蛋白(如 NADH脱氢酶,硫氧还蛋白等),最终进化成今天的全尺寸复合物 I 。
通过以上的介绍可以看出来,线粒体复合物 I 与氢化酶有千丝万缕的联系,特别是复合物 I 的Q模块本身就与[NiFe]氢化酶同根生,辅酶Q接受电子的N2位点与[NiFe]氢化酶的活性中心对应,但是在线粒体复合物 I 中,与活性中心金属配位的半胱氨酸突变导致氢化酶的活性“丧失”,由辅酶Q“替代”H+接受电子,这也是现有的研究认为线粒体复合物 I 不再具有氢代谢能力的原因。
但是,关于复合物 I 还有很多未解之谜,如电子的传递是如何导致质子泵出的?电子、质子、负氢离子、辅酶Q、氢分子(H2)、以及我们在第一篇“生命中的氢元素”介绍的氢键在酶活性位点附近是怎样的存在方式?尽管复合物 I 的精细结构已经解析,但电子传递是如何偶联质子泵出的细节还有待揭秘,也许还有很多没有考虑到的因素。我们推测氢分子是有可能以某种方式参与酶的活性中心的这些过程的。
参考文献
Moparthi V K , Cecilia Hägerhäll. The Evolution of Respiratory Chain Complex I from a Smaller Last Common Ancestor Consisting of 11 Protein Subunits[J]. Journal of Molecular Evolution, 2011, 72(5-6):484-497.
Chen L B . Mitochondrial membrane potential in living cells. Ann Rev Cell Biol 4:151-181[J]. Annual Review of Cell Biology, 1988, 4:155-181.
Yu H , Wu C H , Schut G J , et al. Structure of an Ancient Respiratory System[J]. Cell, 2018:S0092867418304033.
Schoelmerich M C , Volker Müller. Energy-converting hydrogenases: the link between H2 metabolism and energy conservation[J]. Cellular and Molecular Life Sciences, 2020, 77(1636–1649).
Yip CY, Harbour ME, Jayawardena K, Fearnley IM, Sazanov LA. Evolution of respiratory complex I: "supernumerary" subunits are present in the alpha-proteobacterial enzyme. J Biol Chem. 2011;286(7):5023-5033. doi:10.1074/jbc.M110.194993
Degli Esposti M. The long story of mitochondrial DNA and respiratory complex I. Front Biosci (Landmark Ed). 2017 Jan 1;22:722-731. doi: 10.2741/4512. PMID: 27814642.