肾结石的患病率一直在增加在全球范围内和在中国17个成年人中就有一人患有肾结石(1、2)。结石患者在患慢性肾脏疾病(CKD)的风险和肾功能衰竭,进而损害生活质量和加重财政负担(3,4)。因此,这对寻找潜在的治疗肾结石的方法具有重要意义。
草酸钙是肾结石最常见的成分,可与肾小管上皮细胞相互作用,诱导氧化应激、炎症和纤维化,进一步促进肾小管细胞损伤(5)。氧化应激与对草酸钙晶体的反应产生过量的活性氧(ROS)有关,可通过抗氧化剂和自由基清除剂加以改善(6)。ROS可激活炎症小体和各种转录因子,导致炎症细胞因子的产生。过度的氧化应激和炎症不仅增强了草酸钙晶体在管状细胞中的沉积和保留,而且还会导致纤维化的发生(7)。因此,在这一领域探索抗氧化、抗炎、抗纤维化的有效治疗方法是迫切需要的。
以往的基础和临床研究表明,氢分子在不同系统的多种疾病中具有抗氧化、抗炎、抗纤维化、抗凋亡等多种生物学作用(8)。本组报道吸入氢气可缓解乙醛酸诱导的小鼠草酸钙沉积及血、尿代谢紊乱(9,10)。饮用富氢水(富氢水)代表了分子氢输送的另一种方式。富氢水的主要优点是它是一种便携式、易于管理和安全的氢气输送方式。因此,富氢水对草酸诱导的肾脏损伤的潜在作用有待进一步研究。
既往研究表明,喂食可溶草酸盐饲料是成功的草酸钙结晶小鼠模型,具有CKD的特征。在本研究中,建立草酸饮食引起的肾脏损伤,以确定富氢水的治疗效果。RNA测序(RNA-seq)作为一种检测转录组表达水平的技术,具有定量准确、重现性高、检测范围广的优点(13)。本研究采用RNA-seq分析方法,检测饲喂正常饲料和草酸饲料的小鼠肾组织中mRNA表达谱。随后,分析和筛选草酸饲料诱导肾损伤的可能途径。这项研究的目的是为富氢水对抗草酸诱导的肾脏损伤的潜在机制提供新的见解。
一、材料和方法
1、动物实验
6-7周龄、体重25-30 g的雄性ICR小鼠购自上海捷思捷实验动物有限公司,让其适应实验室环境1周。动物实验方案经海军军医大学医学研究伦理委员会批准。将24只小鼠随机分为3组:第1组(ND正常对照组,n = 8)给予正常饮食和正常饮水,连续14 d;第2组(OD结石组,n = 8)给予草酸饲粮加普通水,连续14 d;第3组(OH氢水治疗组,n = 8)给予草酸饲料和富氢水,连续14 d。正常饲料(SLACOM,中国上海)为小鼠常规饲养饲料(P1101F)。通过在无钙日粮(TD.95027)中添加草酸钠(50 μmol /g)制备高草酸饲料。富氢水(氢浓度≥2.5 ppm)由氢水装置(Nanobubble)生产。为了减少氢的损失,富氢水储存在铝袋中,每8小时更换一次。通过温和搅拌24h脱气富氢水产生常规水。
实验结束时,所有的老鼠都被麻醉。取血,3000 rpm离心10分钟后取血清,−80℃保存。原位心脏灌注后,立即取出右肾,并保存在−80°C。然后,切除左肾,用10%缓冲福尔马林固定。
2、生化指标的测定
用商品试剂盒测定小鼠血清肌酐(SCr)、尿素氮(BUN)、丙二醛(MDA)、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)和过氧化氢酶(CAT)。采用相应试剂盒检测小鼠血清中肾损伤分子-1 (KIM-1)、中性粒细胞明胶酶相关脂calin (NGAL)、肿瘤坏死因子-α (TNF-α)、白细胞介素-1β (IL-1β)水平。
3、肾组织学
肾标本固定在10%缓冲福尔马林中,石蜡包埋,切片厚度4 μm,苏木精伊红(HE)染色。在he染色的切片中,肾小管损伤评分按0 - 5分进行半定量评分:0 =正常组织学;1 =仅变性,无坏死;2~5分别为< 25、< 50、< 75、> 75%的上皮细胞,表现为坏死、变性、再生、小管扩张、蛋白管型和间质淋巴细胞浸润。肾晶体用偏光显微镜观察。pizzolato染色时,将硝酸银-过氧化氢溶液加入切片。紫外灯照射30分钟后,用蒸馏水彻底冲洗。切片在核坚红溶液中反染5min,常规脱水。间质纤维化区域采用Masson三色染色,染色呈深蓝色。
将在−80°C下保存的肾脏样品制备成冷冻切片,以检测肾脏活性氧(ROS)的生成。切片用磷酸盐缓冲盐水(PBS)冲洗2次,用20 μM二氢乙锭在37℃无光下用2ml无血清DMEM稀释。孵育30分钟后,PBS冲洗3次,荧光显微镜观察红色荧光图像。
4、免疫组织化学分析
5、RNA-seq分析
采用TRIzol试剂(Invitrogen, Carlsbad, CA, USA)从正常对照组和结石组小鼠肾组织中提取总RNA。然后,用Qubit RNA检测试剂盒分析RNA的完整性、纯度和浓度。之后,用Oligo (dT)磁珠浓缩mRNA,并随机破碎成短片段。用AMPure XP珠从模板mRNA中合成并纯化双链cDNA。通过end Repair Mix完成cDNA末端序列,添加poly A tail和测序连接器。纯化连接产物并分离片段,采用PCR技术进行cDNA文库扩增。最后,使用HiSeq Illumina系统进行测序。
使用fastQC对原始数据质量进行目视评价。然后使用Trimmomatic 对原始数据进行处理和过滤。采用TPM法测定基因表达水平。采用DESeq算法筛选q值< 0.05、|log2FoldChange| > 1和至少一组平均TPM值> 5的差异表达基因(DEGs)。
6、生物信息学分析
使用京都基因与基因组百科全书(KEGG)路径分析,根据clusterProfiler 确定差异基因的重要路径。利用STRING数据库构建蛋白质相互作用(PPI)网络。使用Cytoscape 进行交互网络的可视化探索。利用Cytoscape插件cytoHubba鉴定hub基因。
7、免疫印迹分析
8、统计分析
实验数据以均数±均数标准误差(SEM)表示,采用SPSS 22.0统计软件进行分析,采用单因素方差分析,然后进行Tukey后测。p值<0.05认为差异有统计学意义。
二、结果
1、富氢水可改善草酸诱导的晶体沉积和小鼠肾损伤
通过对肾脏切片进行pizzolato染色和偏振显微镜观察,发现在饲喂高可溶性草酸盐饲料14天的小鼠肾脏中有广泛的草酸钙晶体沉积。富氢水显示肾中草酸钙晶体较少(图1A-C)。HE染色显示结石组肾脏明显改变,如肾小管扩张,上皮细胞变性坏死,肾间质炎症细胞浸润,富氢水可减轻这些组织学损伤(图1A,D)。与正常对照组相比,结石组小鼠肾脏中OPN和CD44的表达增加,而富氢水组小鼠肾脏中OPN和CD44的表达降低(图1A,E,F)。与正常对照组相比,结石组小鼠血清SCr、BUN、KIM-1、NGAL水平均显著升高。然而,这些生物标志物的含量在富氢水处理后显著降低(图1G-J)。
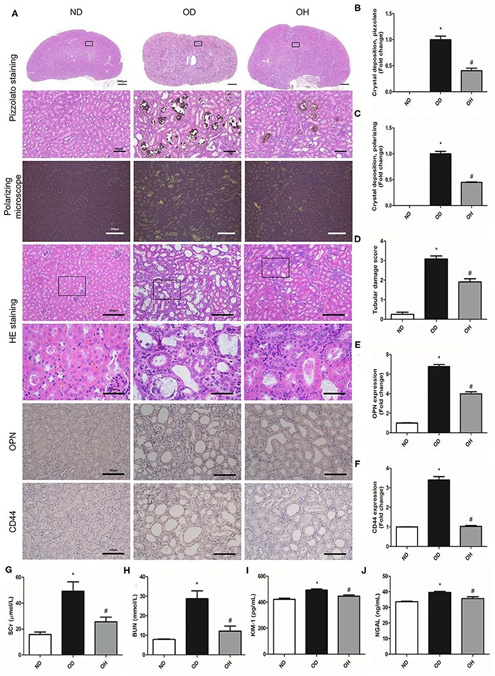
图1.富氢水可改善草酸诱导的晶体沉积和小鼠肾损伤。
2、富氢水可改善草酸诱导的小鼠炎症和氧化应激
在炎症指标方面,结石组小鼠血清TNF-α、IL-1β水平高于正常对照组,富氢水组小鼠血清TNF-α、IL-1β水平降低(图2A、B)。在氧化应激标志物方面,结石组小鼠血清中MDA含量较正常对照组显著升高,SOD、GAH-Px和CAT活性较正常对照组显著降低。但在氢水治疗组中,这些标记的水平是相反的(图2C-F)。然后分析小鼠肾脏中NOX2和NOX4蛋白的表达情况。与正常对照组相比,结石组NOX2和NOX4表达增强,富氢水处理下NOX2和NOX4表达下调(图2G)。此外,高草酸饮食增加的肾脏ROS产生通过富氢水治疗得到缓解(图2H)。
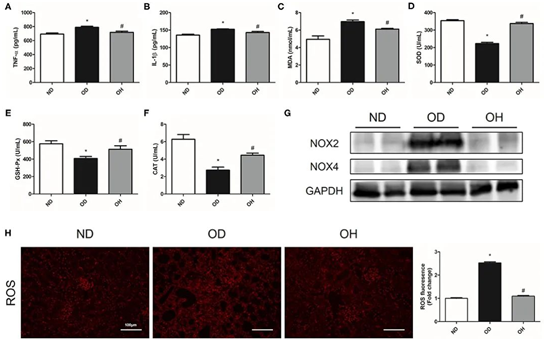
图2.富氢水可改善草酸诱导的小鼠炎症和氧化应激。
3、富氢水给药减轻草酸诱导的小鼠肾纤维化
采用Masson三色染色法测定肾胶原蛋白程度的相对含量,以反映肾纤维化程度。研究表明,富氢水治疗可改善高草酸饮食引起的肾间质纤维化(图3A,B)。免疫组化显示结石组小鼠肾脏中α-SMA、FN和COL IV的表达较正常对照组升高,富氢水组下调(图3A, C-E)。同样,western blotting显示,富氢水处理降低了肾脏中高草酸饲料引起的α-SMA、FN和COL IV蛋白表达的增加(图3F)。
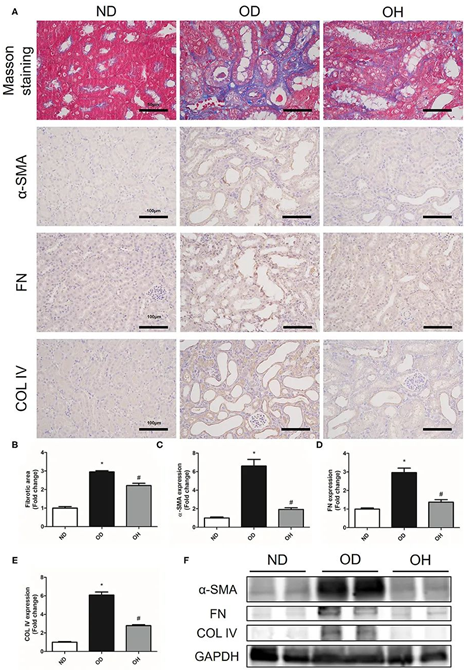
图3.富氢水可减轻草酸诱导的小鼠肾纤维化
4、RNA-seq分析和KEGG通路分析
采用RNA-seq分析比较正常对照组和结石组肾组织的基因表达谱。以q<0.05、|log2FoldChange| > 1和至少一个组的平均TPM值> 5为标准选择DEGs。共筛选出3566个DEGs, 结石组与正常对照组之间有3091个上调的DEGs, 475个下调的DEGs,如图直方图、散点图和火山图所示(图4A-C)。聚类热图显示结石组和正常对照组的基因表达模式不同(图4D)。所有鉴定的deg均通过ClusterProfiler R包进行KEGG分析。KEGG分析在富集分析中识别了多种途径,并将前50条途径可视化(图4E)。选择PI3K/AKT信号通路、NF-κB信号通路和TGF-β信号通路进一步探讨富氢水给药对草酸诱导肾损伤的影响。
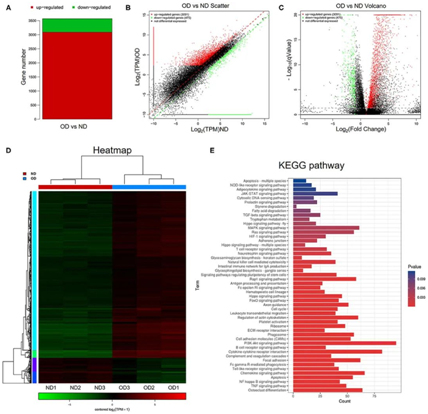
图4.RNA-seq分析和KEGG通路分析。
5、富氢水可抑制草酸诱导的小鼠PI3K/AKT信号通路的激活
在PI3K/AKT信号通路中,共富集了95个DEGs,在结石组和正常对照组之间有90个DEGs表达上调,5个DEGs表达下调,聚类热图(图5A)。将这95个基因输入STRING数据库进行PPI网络,发现Akt1、Fn1、Trp53、Igf1、Itgb1、Jak2、Pik3r1、Nras、Hgf、Myc等10个枢纽基因(图5B)。随后采用western blotting检测PI3K/AKT信号通路关键分子的表达。与正常对照组相比,结石组小鼠肾脏中PI3K、AKT和p-AKT蛋白表达增强,富氢水组小鼠肾脏中PI3K、AKT和p-AKT蛋白表达下调(图5C)。同样,免疫组化显示,高草酸饮食导致肾脏中PI3K和p-AKT的表达增加,富氢水处理降低(图5D-F)。
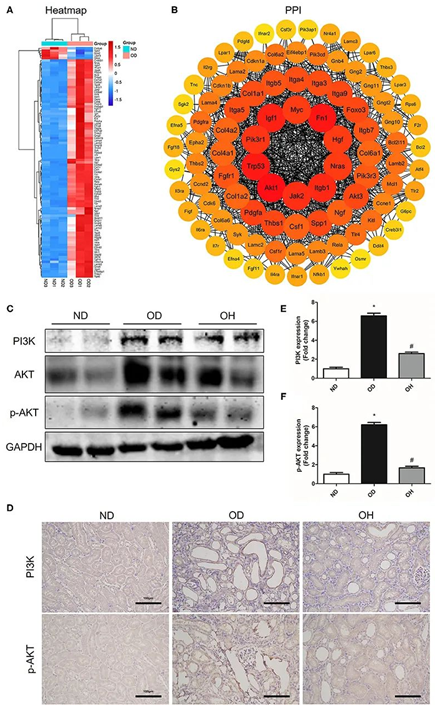
图5.富氢水可抑制草酸诱导的小鼠PI3K/AKT信号通路的激活。
6、富氢水可抑制草酸诱导的NF-κB信号通路的激活
聚类热图显示,与正常对照组相比,结石组NF-κB信号通路中有43个DEGs富集,且这些基因均上调(图6A)。将这43个基因通过STRING数据库构建一个PPI网络,发现8个hub基因,包括Myd88、Tlr4、Cd40、Traf3、Rela、Tnfrsf1a、Il1b、Nfkbia(图6B)。然后通过免疫组织化学和western blotting检测NF-κB信号通路中关键分子的表达。结果显示,结石组NF-κB p65、p-NF-κB p65、NLRP3、IL-1β表达水平均高于正常对照组。但在氢水治疗组中这些分子的表达水平相反(图6C)。免疫组化还提示,富氢水处理可抑制高草酸饲料诱导的NF-κB p65、p-NF-κB p65、NLRP3和IL-1β表达的增加(图6D-H)。
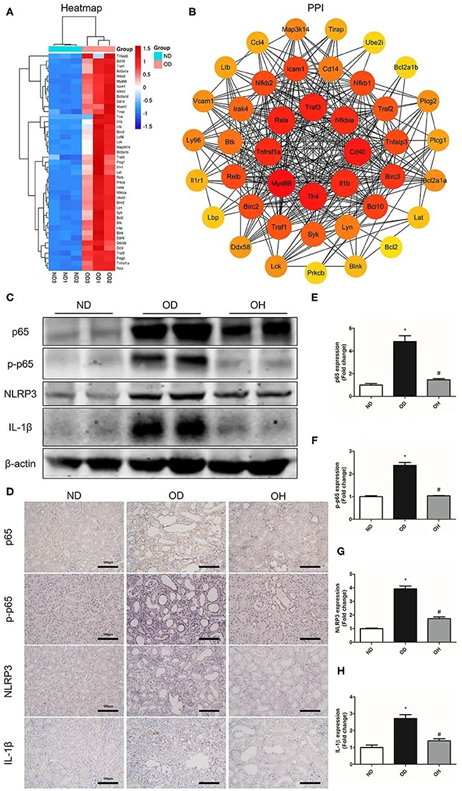
图6.富氢水可抑制草酸诱导的NF-κB信号通路的激活。
7、富氢水可抑制草酸诱导的TGF-β信号通路的激活
聚类热图显示,TGF-β信号通路中共富集了25个DEGs,且结石组中这些基因均较正常对照组上调(图7A)。然后将这25个基因输入STRING数据库进行PPI网络,发现8个hub基因,包括Smad3、Tgfbr2、Tgfb1、Tgfbr1、Tgfb3、Tgfb2、Acvr1和Bmpr1a(图7B)。western blotting检测TGF-β信号通路中关键分子的表达。结果显示,与正常对照组相比,结石组TGF-β、TGF-β ri、TGF-β rii、p-Smad2、p-Smad3表达水平升高,并随富氢水处理而下调(图7C)。同样,免疫组化显示富氢水处理可降低高草酸饲料引起的TGF-β、p-Smad2和p-Smad3表达升高(图7D-G)。
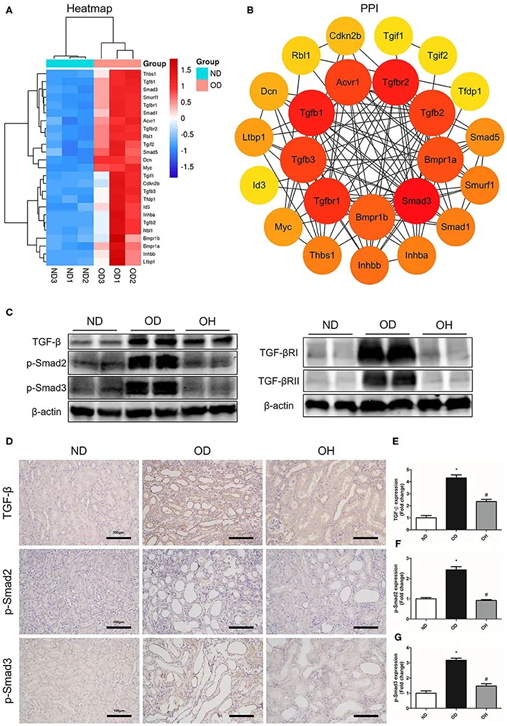
图7.富氢水可抑制草酸诱导的TGF-β信号通路的激活。
三、讨论
法。既往研究表明,导致肾结石形成的病理生理机制涉及氧化应激、炎症和纤维化。分子氢可作为细胞和器官重要的生理调节因子,具有抗氧化、抗炎、抗纤维化等保护作用(8)。我们通过喂食可溶性草酸饲料建立了小鼠草酸钙模型,并证明富氢水可以减轻小鼠草酸钙晶体沉积和肾损伤。
研究证实,ROS过量产生和抗氧化剂减少导致的氧化应激参与了草酸钙晶体诱导的肾小管细胞损伤,这在肾结石的形成中发挥了重要作用(6,7)。我们发现,富氢水可通过降低MDA含量、提高SOD、GSH-Px和CAT水平来缓解草酸饲料诱导的氧化应激。此外,富氢水也降低了肾组织中ROS的生成。ROS过量产生可激活PI3K/AKT和NF-κB信号通路,进一步加重肾损伤(15)。
PI3K/AKT通路参与了许多关键的细胞功能,包括蛋白质合成、细胞周期进展、增殖、凋亡和自噬(16)。由ROS等条件激活的PI3K可催化膜磷脂磷脂酰肌醇4,5 -二磷酸(PIP2)转化为磷脂酰肌醇3,4,5 -三磷酸(PIP3)。PIP3磷酸化并激活AKT,从而促进下游靶基因的激活和转录,如糖原合成酶激酶3β (GSK-3β)、哺乳动物雷帕霉素靶基因(mTOR)、Snail和NF-κB(17-19)。有研究表明PI3K/AKT的激活可以诱导GSK-3β的磷酸化和Snail的上调,这可以诱导成纤维细胞的激活和基质生产的积累在梗阻的肾脏(20)。此前的一项研究发现,在草酸钙小鼠模型中,乙二醇灌胃可激活PI3K/AKT信号通路,PI3K/AKT通路失活抑制草酸钙晶体沉积和肾脏上皮-间质转化(EMT)的发展(21)。然而,另一项研究表明,miR-155通过抑制PI3K/Akt/mTOR信号通路激活自噬,促进草酸钙晶体诱导的肾小管上皮细胞损伤(22)。在我们的研究中,我们发现草酸饮食激活PI3K/AKT通路,富氢水抑制PI3K/AKT通路。因此,我们推测富氢水可能通过抑制氧化应激介导的PI3K/AKT信号通路来改善草酸诱导的肾损伤。
转录因子NF-κB在一系列细胞过程中起着至关重要的作用,包括炎症、细胞粘附、免疫、分化、增殖和凋亡(23)。NF-κB通路在响应氧化应激和其他条件时被触发,然后NF-κB易位进入细胞核,促进TNF-α、IL-1β和单核细胞趋化蛋白1 (MCP-1)的转录(24)。NLRP3炎性小体在IL-1β成熟和炎症中起着关键作用。一方面,NLRP3炎性小体可加速NF-κB活化,促进NF-κB通路介导的炎症反应(25)。另一方面,NF-κB又可以通过与NLRP3启动子结合而促进NLRP3的转录(26)。既往研究表明,在草酸钙晶体诱导的肾损伤中,NF-κB和NLRP3炎性小体通路被激活,炎性细胞因子的产生增加。此外,抑制NF-κB和NLRP3炎症小体可减少炎症介质的释放,改善草酸钙晶体诱导的肾脏炎症(27,28)。此外,已经证明草酸盐通过激活NF-κB在肾小管细胞中诱导OPN的表达(29)。OPN作为结石基质的主要有机成分,通过与草酸钙晶体的受体CD44结合,促进草酸钙晶体与管状细胞表面的粘附(30)。在本研究中,我们发现高草酸饲料喂养的小鼠血清中TNF-α和IL-1β水平上调,肾组织中OPN和CD44的表达增加,NF-κB通路被激活。人权观察行政部门改善了这些情况。因此,我们假设富氢水可以通过抑制NF-κB信号通路来缓解草酸诱导的肾脏炎症。
结石形成过程中过度的氧化应激和炎症不可避免地促进肾小管细胞EMT和肾纤维化(31)。TGF-β是一种在肾脏疾病中发现的促纤维化细胞因子,它诱导肾脏细胞产生细胞外基质蛋白,导致肾小管间质纤维化(32)。TGF-β/Smad信号通路是进展性肾纤维化的主要途径。有研究表明,Smad2和Smad3在CKD患者和动物模型的纤维化肾脏中被激活(33)。同样,我们之前的研究报道了TGF-β/Smad通路在腹腔注射乙醛酸盐的草酸钙小鼠模型中被激活,导致EMT和肾纤维化(34)。在本研究中,我们发现草酸饲料增加了胶原含量和成纤维细胞因子的表达,激活了TGF-β/Smad通路。人权观察的管理可以改善这些条件。因此,我们推测富氢水可以通过抑制TGF-β/Smad信号通路来改善草酸诱导的肾纤维化。
基于以上分析,总结富氢水对草酸诱导的肾损伤的可能机制(图8)。高草酸饲料诱导的草酸钙晶体增加激活NADPH氧化酶,增加肾脏ROS的产生。ROS可进一步激活PI3K/AKT、NF-κB、TGF-β等通路,增加炎症因子的产生和胶原沉积,促进炎症和纤维化。富氢水可能通过抑制PI3K/AKT、NF-κB和TGF-β信号通路,改善氧化应激、炎症和纤维化,从而缓解草酸诱导的肾损伤。
全文摘要图
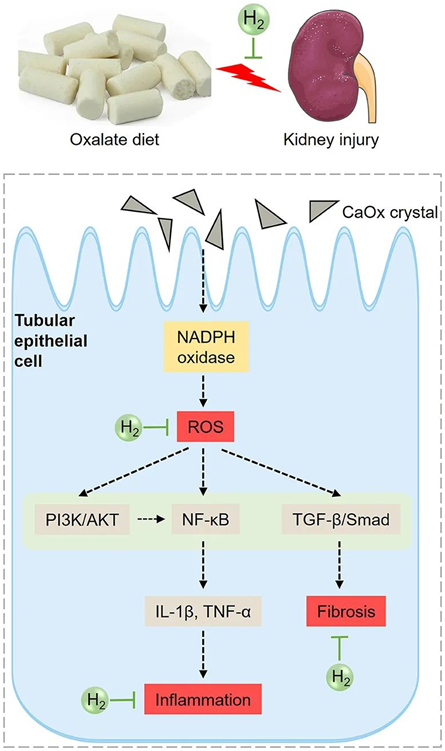
图8.富氢水对草酸诱导肾损伤的作用示意图。高草酸饲料诱导的草酸钙晶体增加激活NADPH氧化酶,增加肾脏ROS的产生。ROS可进一步激活PI3K/AKT、NF-κB、TGF-β等通路,增加炎症因子的产生和胶原沉积,促进炎症和纤维化。富氢水可能通过抑制PI3K/AKT、NF-κB和TGF-β信号通路,改善氧化应激、炎症和纤维化,从而缓解草酸诱导的肾损伤。