宋教授提出的假说是氢气能稳定肥大细胞,这是一个不错的假说,其实如果氢气能稳定肥大细胞,则不仅对于动脉硬化,对于氢气抗炎症效应都可以一起解释。因为肥大细胞在炎症反应中属于预警细胞,是免疫系统中最早发现问题,并招募更多类炎症细胞参与炎症反应的重要细胞,如果能稳定这种细胞,那么显然就可以避免炎症的发生。
也正是因为这种细胞太重要,氢气如果能抑制肥大细胞的功能,则有可能会干扰正常的免疫炎症过程,这和氢气的安全性比较大不那么贴切。另外,如果氢气能稳定肥大细胞,这种稳定的基础能否可以推广到其他炎症细胞,例如中性颗粒细胞和巨噬细胞,氢气作为一种缺乏结构特异性的气体分子,很难想象能对肥大细胞具有专一性。
纯属于个人看法,不一定正确。
动脉粥样硬化性心血管疾病的全球发病率和死亡率相当之高,甚至被称为“死亡杀手”。急性的缺血性心血管综合症,例如心肌梗塞,中风等都是源于斑块的侵蚀破裂。动脉粥样硬化发生发展中,炎症细胞(例如,巨噬细胞、T细胞和肥大细胞)逐渐聚集和过度释放促炎细胞因子和蛋白水解酶等,导致斑块纤维帽变薄,斑块心血管化且伴随微量出血,促成斑块破裂,引起心血管事件[1]。
肥大细胞(mast cell)属于嗜碱性粒细胞家族,主要分布在皮肤及内脏粘膜下的微血管周围,通过分泌多种细胞因子,参与免疫调节。动脉粥样硬化发生时,在胸主动脉、腹主动脉和冠状动脉中斑块中的肥大细胞的数目要高出正常人几倍:2013年,Willems等对253名颈动脉狭窄患者进行了长达3年的临床观察研究,组织学结果表明肥大细胞在颈动脉斑块的数量增加与动脉粥样硬化斑块进展程度正相关[2]。Bot I等发表于Circulation的机制研究表明血管周激活的肥大细胞能通过诱导巨噬细胞凋亡加速动脉粥样硬化并增强斑块脆性[3]。上述研究提示,肥大细胞激活可能通过其脱颗粒机制诱发动脉粥样硬化。
氢分子生物医学是我们团队在最近6-7年中凝练出的新研究方向。氢分子具有选择性抗氧化和稳定生物膜的生物学效应:2009年,Itoh T等发现氢气能通过抑制还原型尼克酰胺腺嘌呤二核苷酸磷酸氧化酶( NADPH)减弱Lyn磷酸化,稳定肥大细胞膜并抑制其脱颗粒。[4] 我们团队近些年系列论文已证实,氢分子能通过抑制巨噬细胞凋亡有效减轻动脉粥样硬化斑块发生发展并稳定斑块,并对相关机制进行了解释。但动脉粥样硬化发生发展中的病因和病理机制非常复杂,氢分子是否通过其它机制,比如肥大细胞相关途径产生抗动脉粥样硬化和稳定作用?特别是肥大细胞释放的酶类对脂蛋白颗粒的修饰在动脉粥样硬化发生发展过程中所扮演的角色,可能是氢分子抗动脉粥样硬化的新靶点。望感兴趣的同仁,特别是有肥大细胞研究基础的同行关注。
补充一点,美国罗马琳达大学张和教授有一篇关于氢气吸入对脑出血后肥大细胞作用的研究,发表在《重症医学》上,也应该是该假说的重要依据。该文章《氢思语》同时推送。
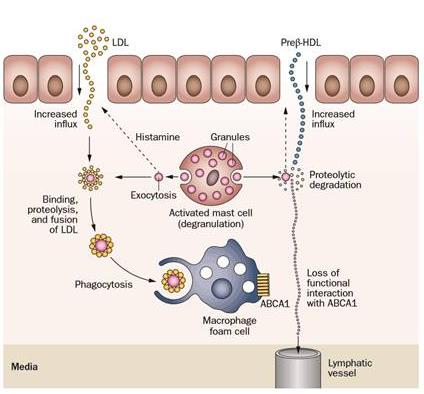
图片来源:Nat Rev Cardiol. 2015
参考文献:
1)Shi GP, Bot I, Kovanen PT. Mastcells in human and experimental cardiometabolic diseases. Nat Rev Cardiol. 2015Nov;12(11):643-58.
2)Willems, S. et al. Mastcells in human carotid atherosclerotic plaques are associated withintraplaquemicrovessel density and the occurrence of future cardiovascular events.Eur. Heart J. 34, 3699–3706 (2013).
3)Bot I, de Jager SC, Zernecke A,Lindstedt KA, van Berkel TJ, Weber C, Biessen EA. Perivascular mast cellspromote atherogenesis and induce plaque destabilization in apolipoproteinE-deficient mice. Circulation. 2007 May 15;115(19):2516-25.
4)Itoh T, Fujita Y, Ito M, MasudaA, Ohno K, Ichihara M, Kojima T, Nozawa Y, Ito M. Molecular hydrogen suppressesFcepsilonRI-mediated signal transduction and prevents degranulation of mastcells. BiochemBiophys Res Commun. 2009 Nov 27;389(4):651-6.