低浓度氢气对小鼠哮喘和睡眠功能的影响
吸入低浓度氢气对小鼠哮喘和睡眠功能的影响支气管哮喘(简称哮喘)是由多种炎性细胞及细胞组分共同引起的慢性气道炎症疾病,其发生发展主要与呼吸系统炎症反应和氧化应激密切相关[1]。
(许多人可能认为哮喘就是哮喘发作,其实哮喘是一种慢性病,或者是慢性炎症疾病。氢气抗炎症角度,对哮喘应该有比较好的改善效果,特别是能进行吸入改善,这对于气道炎症来说,是非常可贵的改善方法。另外,氢气由于密度小,对气道狭窄的哮喘来说,也具有对症改善意义)。
哮喘目前尚无法根治,临床多采用控制药物或缓解药物进行改善,包括糖皮质激素、β2受体激动剂、抗胆碱能药物以及抗IgE抗体等,但均存在各种药物不良反应[2]。
随着氢气医学的发展,氢气对呼吸系统疾病的作用得到了广泛研究[3]。2015年,张宁等[4]发现吸入660 mL/L高浓度氢气对支气管哮喘大鼠有明显改善作用。2019年,黄等[5]发现吸入420 mL/L高浓度氢气对支气管哮喘小鼠也有明显改善作用。这些研究提示氢气对哮喘可能具有明显疗效。然而富含氢的生理盐水制备过程繁琐、使用不便,而高浓度氢气的使用危险性又大[6]。因此,探究吸入低浓度氢气对哮喘小鼠是否有改善作用意义重大。睡眠障碍在哮喘患者中普遍存在,睡眠质量差不仅加重病情,而且给患者的生活和工作带来不便,严重影响患者身心健康[7]。目前常用的睡眠改善包括认知行为改善(CBT-I)和镇静催眠药物,但CBT-I干预即刻效应差,长期反复使用药物容易使机体出现药物耐受性[8]。2013年,MATSUMOTO等[9]发现小鼠饮用富含氢的水能增加具有神经保护作用的胃饥饿素分泌。2018年,MIZUNL等[10]一项临床研究发现饮用氢水可以改善自主神经系统功能,调节情绪和焦虑,提高受试者的生活质量。然而吸入低浓度氢气对睡眠功能的影响目前国内外尚无报道。
本实验研究设计吸入24~26 mL/L低浓度氢气改善卵清蛋白(ovalbumin,OVA)诱导的小鼠哮喘,观察小鼠肺组织病理学改变,检测肺泡灌洗液(bronchoalveolarlavagefluid, BALF)中白细胞介素(interleukin, IL)-4、IL-13、干扰素-γ(interferon-γ,IFN-γ)的水平和肺组织丙二醛(malondialdehyde, MDA)、谷胱甘肽(glutathione,GSH)含量和超氧化物歧化酶(superoxidedismutase,SOD)活性,探索低浓度氢气对哮喘小鼠的改善效果与潜在机制。同时通过观察吸入低浓度氢气对给予戊巴比妥钠小鼠睡眠功能的影响,初步探索氢气对睡眠功能的改善作用。
1材料和方法
1.1主要仪器与试剂
OVA(北京索莱宝公司),佐剂氢氧化铝(成都科隆公司),戊巴比妥钠(德国Merck公司),地西泮注射液(上海旭东海普药业公司,批号AH181001),小鼠IL-4、IFN-γELISA检测试剂盒(深圳市达科为公司),小鼠IL-13ELISA检测试剂盒(武汉优尔生公司),小鼠MDA、SOD、GSH检测试剂盒(南京建成生物公司)。QMK-98500Y氢美康医用氢气改善仪和QMK-SY3动物雾化致敏箱(深圳市量子氢生物技术有限公司),403T压缩空气式雾化器(江苏鱼跃医疗设备股份有限公司),TCL-16M台式高速冷冻离心机(上海卢湘仪公司),Varioskan LUX酶标仪(赛默飞科技中国公司)。
1.2实验动物
SPF级BALB/c小鼠和ICR小鼠,雌雄各半,体质量(20±2)g,由成都市达硕实验动物有限公司提供,生产许可证号为SCXK(川)2015-030。动物实验均遵循我国《实验动物福利伦理审查指南(GB/T 35892 2018)》要求。
1.3吸入低浓度氢气对OVA诱导小鼠哮喘的影响
1.3.1哮喘模型建立与氢气改善方法 35只BALB/c小鼠适应性喂养3d后,按照体质量随机分为正常对照组、哮喘模型组和氢气改善组,雌雄各半,每组11~12只。第1、7、14天,哮喘模型组和氢气改善组小鼠腹腔注射200 μLOVA混悬液(100 μg OVA,2mg佐剂氢氧化铝),此为致敏阶段,正常对照组小鼠腹腔注射等量PBS溶液。第21天开始将每组小鼠置于自制雾化吸入箱内,每天上午雾化吸入50 g/L OVA,30 min,此为激发阶段,正常对照组小鼠雾化吸入等量PBS溶液。同时氢气改善组小鼠每天下午吸入24~26mL/L氢气30 min,连续7 d,正常对照组和哮喘模型组小鼠在相同条件下吸入空气,最后一次OVA激发改善后24 h取材。
1.3.2 BALF和肺组织标本的采集 小鼠经戊巴比妥钠麻醉后打开胸腔并结扎左肺,通过无菌注射器经气管注入1 mL 0.01 mol/L PBS,停留10s后慢慢抽出,重复一次。将两次取得的肺泡灌洗液于4 ℃、3 000×g离心15 min,小心吸取上清液−80℃保存待用。取左肺置入16 g/L甲醛溶液中固定,后续石蜡包埋切片,进行HE染色。右肺组织精确称重后,加入9倍体积的灭菌生理盐水充分匀浆,4 ℃、3 000×g离心10 min,小心吸取上清−80℃保存待用。
1.3.3 BALF中细胞因子测定 取适量BALF冰上溶解,ELISA法检测IL-4、IL-13、IFN-γ的质量浓度,具体操作严格按照试剂盒说明书执行。
1.3.4肺组织匀浆中氧化性指标测定 取适量肺组织匀浆冰上溶解,比色法检测MDA、GSH含量以及SOD活性,具体操作严格按照试剂盒说明书执行。
1.3.5肺组织形态学观察 左肺组织石蜡切片进行HE染色,光学显微镜下观察各组小鼠肺组织形态学改变。
1.4吸入低浓度氢气对小鼠睡眠的影响
1.4.1吸入低浓度氢气对小鼠睡眠时间的影响 SPF级ICR小鼠,雌雄各半,实验前适应性喂养3 d,称重后随机分为空白对照组,氢气改善1 d、3d、5 d组和地西泮组,每组10只。空白对照组和地西泮组每日上午和下午两次分别吸入空气,氢气改善组每日上午和下午两次分别吸入24~26 mL/L氢气,每次30 min;地西泮组在第5天腹腔注射地西泮2.5mg/kg。空白对照组和氢气改善组末次空气或氢气吸入结束后、地西泮组给药间隔1 h后,腹腔注射戊巴比妥钠阈上剂量(使100%小鼠入睡的最低剂量,预实验为60 mg/kg)。观察30 min内各组动物入睡情况,计算睡眠潜伏期与睡眠时间(当小鼠置于背卧位时,超过60 s不能翻正判定为翻正反射消失,即小鼠睡眠;翻正反射恢复即为小鼠觉醒)。
1.4.2吸入低浓度氢气对小鼠睡眠发生率的影响 小鼠分组与给药同1.4.1。空白对照组和氢气改善组末次空气或氢气吸入结束后、地西泮组给药间隔1 h后,腹腔注射戊巴比妥钠阈下剂量(使90%~100%小鼠翻正反射不消失的最高剂量,预实验为40 mg/kg)。观察30 min内各组动物入睡情况,计算各组小鼠睡眠发生率(入睡动物只数/每组动物数× 100%)。
1.5统计学方法
计量资料以x¯ _s表示,组间差异比较采用单因素方差分析,方差不齐时采用秩和检验;计数资料以百分率表示,组间差异比较采用卡方检验。P<0.05为差异有统计学意义。
2结果
2.1吸入低浓度氢气对小鼠哮喘的影响
2.1.1 BALF中炎症细胞因子水平变化
与正常对照组相比,哮喘模型组小鼠BALF中IL-4和IL-13质量浓度增加(P<0.05),IFN –γ质量浓度降低(P<0.001)。与哮喘模型组相比,氢气改善组小鼠BALF中IL-4和IL-13质量浓度均有所降低(P<0.05),IFN –γ质量浓度增加(P<0.05)。见图1。
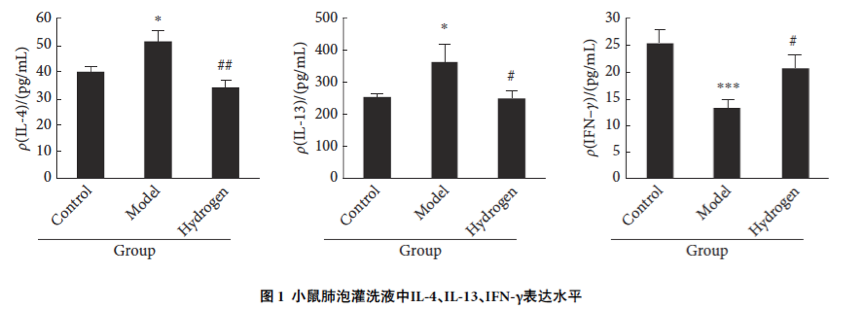
2.1.2肺组织匀浆中氧化性指标的变化
与正常对照组相比,哮喘模型组小鼠肺组织中GSH含量降低(P<0.05),S O D活性有降低趋势(P > 0 . 0 5),M D A含量升高(P<0.01);与哮喘模型组相比,氢气改善组小鼠肺组织中GSH含量增加(P<0.01),SOD活性增加(P<0.05),MDA含量有降低趋势(P>0.05)。见图2。2.1.3肺组织形态学观察 HE染色结果显示,与正常对照组相比,哮喘模型组小鼠肺泡组织塌陷变形,肺泡壁断裂融合为肺大疮,伴随大量的炎性细胞浸润,而氢气改善组小鼠肺泡损伤较轻,肺泡壁变薄,有较少程度的肺泡壁断裂,伴随较少炎性细胞浸润。见图3。
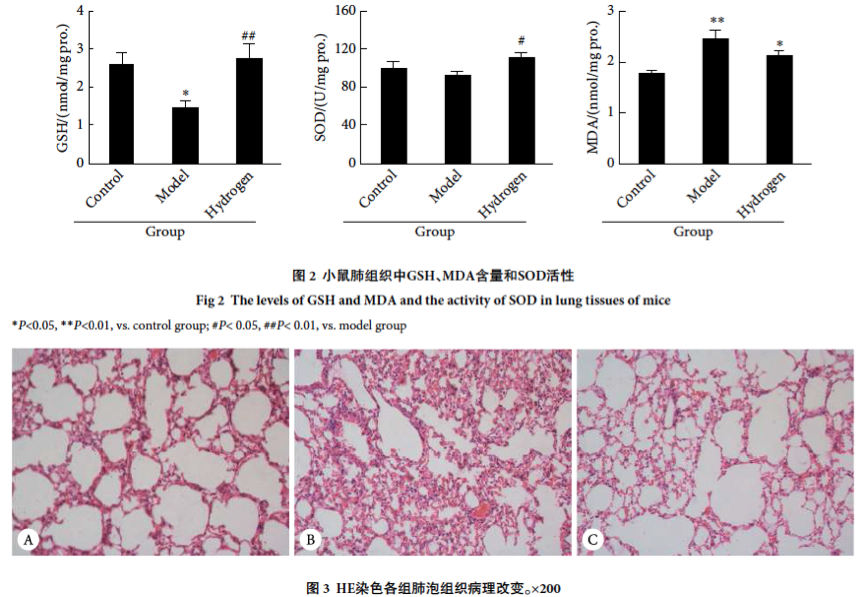
2.2吸入低浓度氢气对小鼠睡眠的影响
2.2.1对阈上剂量戊巴比妥钠诱导小鼠睡眠时间的影响
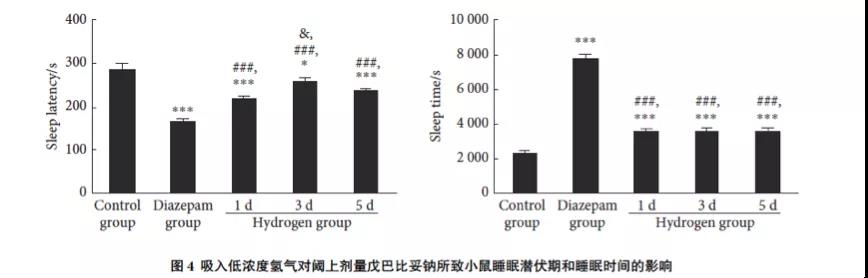
与空白对照组比较,地西泮组和各氢气改善组小鼠睡眠潜伏期均缩短(P<0.05),睡眠时间均延长(P<0.001)。各氢气改善组小鼠睡眠潜伏期均长于地西泮组(P<0.001),而睡眠时间均短于地西泮组(P<0.001)。各氢气改善组间比较,仅1 d和3 d组间睡眠潜伏期差异有统计学意义(P<0.05)。见图4。
2.2.2对阈下剂量戊巴比妥钠诱导小鼠睡眠发生率的影响
与空白对照组(20%,2/10)比较,地西泮组小鼠睡眠发生率(100%)增加(P<0.001);氢气吸入1 d(80%,8/10)和5 d组(80%,8/10)小鼠睡眠发生率增加(P<0.01);氢气改善3 d组睡眠发生率(60%,6/10)有增加趋势,但差异无统计学意义。与地西泮组比较,氢气改善1 d和5 d组睡眠发生率差异无统计学意义;但氢气改善3 d组睡眠发生率低于地西泮组(P<0.05)。各氢气改善组组间比较睡眠发生率差异无统计学意义。
3讨论
氢气是一种无色无味的气体,内源性氢气主要由肠道菌群产生。研究发现氢气具有抗炎、抗氧化、抗凋亡等生物学作用[11],同时氢气穿透力强,扩散快,能快速到达病灶部位,在脓毒血症、脑缺血和肿瘤等疾病的改善中得到广泛研究[12-13]。外源氢气补给的方法多种多样,主要包括呼吸道吸入氢气、饱和氢盐水溶液注射、氢水溶液透析等[14]。目前尚无氢气改善后不良反应报道,表明氢气具有极高的安全性。
本研究采用QMK-98500Y医用氢气改善仪通过电解纯水制备氢气,产生的氢气与空气混合形成24~26 mL/L低浓度氢气,以探索低浓度氢气对小鼠哮喘和睡眠功能的影响。哮喘实验研究发现,通过OVA诱导的小鼠肺组织病理改变明显,肺泡组织塌陷,并伴随大量的炎性细胞浸润,而氢气改善组小鼠肺泡组织损伤较轻,炎性细胞较少。研究报道Th1/Th2细胞失衡及其引起的后续病理变化是导致呼吸系统炎症反应的重要原因。Th2细胞分泌IL-4、IL-13等细胞因子,正向调节免疫功能,其水平与哮喘的严重程度有关[15]。IL-4是诱导炎症的初始因素,其不仅能促进IgE生成,诱导血管内皮黏附因子表达,进而募集淋巴细胞,导致气道炎症,还能抑制Th0细胞向Th1细胞分化。Th1细胞主要分泌IFN-γ等细胞因子,负向调节免疫功能[16]。IFN-γ具有拮抗IL-4的作用,可通过纠正Th1/Th2细胞失衡,缓解哮喘症状[17]。
本研究发现哮喘模型小鼠BALF中IL-4、IL-13质量浓度增加,IFN-γ质量浓度降低,即哮喘模型小鼠呼吸系统Th1/Th2细胞失衡,Th2细胞免疫亢进。吸入低浓度氢气后,与哮喘模型组相比,BALF中IL-4、IL-13质量浓度降低,IFN-γ质量浓度增加,表明吸入低浓度氢气通过纠正哮喘小鼠Th1/Th2细胞失衡,减轻炎症反应。此外,研究显示哮喘的发病机制与呼吸道系统的氧化应激密切相关[18]。生理条件下,机体内氧自由基产生与清除保持稳定,这种稳态主要通过GSH和SOD的抗氧化系统作用维持[19]。研究表明,哮喘患者呼吸道系统的炎性细胞产生大量氧自由基,同时GSH含量与SOD活性显著降低、氧自由基清除减少,从而导致脂质过氧化产物MDA等氧化损伤相关指标水平增加[2 0]。在本研究中,OVA诱导的哮喘小鼠肺组织中GSH含量明显降低、SOD活性轻度降低、MDA水平显著升高,这表明哮喘模型小鼠肺部的氧化应激水平明显增强。
吸入低浓度氢气后,与哮喘模型组相比,氢气改善组小鼠肺组织中抗氧化剂SOD活性和GSH含量得到恢复,脂质过氧化产物MDA含量稍有降低,表明吸入低浓度的氢气能降低哮喘小鼠肺组织氧化应激水平。睡眠作为我们最熟悉的生命活动之一,对维持正常学习、工作和生活具有非常重要的意义。睡眠质量差、睡眠剥夺不仅影响正常生理活动,还将引发心理和行为活动的异常[21]。临床观察发现,氢气吸入对改善睡眠有作用,特别是在晚期癌症患者中效果尤为明显。然而,目前尚无任何研究证据表明氢气对睡眠功能的改善作用。
本研究结果显示连续吸入低浓度氢气1 d、3 d或5 d均可明显缩短阈上剂量戊巴比妥钠所致小鼠睡眠的潜伏期、延长其睡眠时间;同时氢气吸入1 d或连续吸入5 d均可明显提高阈下剂量戊巴比妥钠诱导小鼠的睡眠发生率,以上结果表明低浓度氢气吸入对戊巴比妥钠促进小鼠睡眠有一定协同作用。
研究还发现吸入低浓度氢气对阈上剂量戊巴比妥钠诱导小鼠睡眠潜伏期的缩短与睡眠时间的延长作用均明显弱于地西泮阳性对照药,吸入3 d对睡眠潜伏期的影响小于吸入1 d和5 d组;吸入1 d或5 d对阈下剂量戊巴比妥钠诱导小鼠睡眠发生率的改善作用与地西泮未见明显差异,各氢气改善组之间也未见明显差异,而氢气吸入3 d睡眠发生率较对照组有增加但不及地西泮,以上结果可能与氢气在小鼠体内停留时间以及个体差异有关。
上述结果表明,吸入低浓度氢气对小鼠睡眠功能的影响不及地西泮,但诱导睡眠发生率的效果与地西泮相似,因此吸入低浓度氢气可能是一种温和的改善睡眠的方法,其作用机制也需要进一步探索。综上所述,本研究初步发现吸入低浓度的氢气后能改善哮喘小鼠肺组织损伤、炎症损伤和氧化损伤,同时可以改善小鼠的睡眠功能。低浓度氢气具有安全性高、容易获取、价格低廉、耐受性好等优点,为未来临床改善哮喘和睡眠障碍提供一种新的策略。
上内容摘自《孙学军 氢思语》,仅限于知识科普,不代表对本公司产品的宣传。







