氢气和铁死亡的关系
铁死亡是最近生物医学领域的研究热点。铁死亡是最符合氧化损伤的死亡方式,而铁相关的羟基自由基可能是其中关键。氢气能选择中和羟基自由基,被作为氢气生物学效应的基础。那么氢气对铁死亡的抑制作用似乎是理所当然的。但是关于这两者之间关系的研究非常非常少。最近来自南京鼓楼医院庄宗教授小组率先开展了这一方向的探讨,初步表明有一定关系。不过该研究认为,氢气是通过启动内源性抗氧化实现的减少铁死亡,和传统的关于氢气抗氧化的直接作用不一样。
自发性蛛网膜下腔出血(SAH),由颅内动脉瘤破裂引起的,是一种普遍的急性脑血管疾病[1]。SAH对全球公共健康构成重大威胁,院前死亡率在22%至26%之间[2]。此外,大约50%的SAH幸存者会经历持续的神经功能损伤[3]。尽管手术在预防再出血方面有效,但SAH患者的临床预后并没有显著改善[4,5]。因此,彻底检查SAH后神经损伤的关键机制,并确定潜在的干预疗法以减轻这些伤害是至关重要的。从溶解的红细胞中释放的血红蛋白(Hb)被认为是SAH后神经元损伤的主要催化剂。来源于Hb的大量铁离子在蛛网膜下腔内形成出血微环境。这些多余的铁离子主要通过转铁蛋白-转铁蛋白受体运输系统在神经细胞中积累,随后经历Fenton反应。这一反应导致铁离子与过氧化氢相互作用,产生过量的高毒性羟基和活性氧(ROS)。最终,这一过程诱导了神经元铁死亡[6,7]。此外,神经炎症作为另一个重要因素,也促进了神经损伤[8,9]。具体来说,源自Hb的损伤相关分子模式(DAMPs)在激活微胶质细胞通过Toll样受体4(TLR4)方面发挥着关键作用,随后导致炎症因子的释放[10,11]。这些炎症因子,进一步受到铁离子诱导的ROS刺激[12,13],导致血脑屏障损害、脑血管痉挛和程序性神经细胞死亡[11,14,15]。
值得注意的是,氢气作为一种具有强大抗氧化应激特性的理想治疗气体,已在中枢神经系统(CNS)的各种临床应用中取得成功。我们的初步实验证明了氢气在SAH中的神经保护作用,因为它有效地抑制了氧化应激[20,21],这一点已经得到了日本和美国研究小组的确认[22,23]。然而,氢气抑制神经细胞死亡的机制仍不清楚。需要进一步的研究来阐明氢气在调节SAH中氧化应激诱导的铁死亡中的作用。因此,本研究的主要目的是通过检查氢气对铁死亡和神经炎症的抑制作用,来调查氢气在SAH情况下的潜在神经保护效果。临床试验
我们进行了氢气治疗SAH的临床试验。这项临床试验获得了南京鼓楼医院伦理委员会的批准(编号:2021-569-02)。该研究已在中国国家临床试验注册中心注册(ChiCTR2200059060)。所有参与者均已获得知情同意。本研究符合《随机对照试验报告规范》(CONSORT)。入组的纳入标准如下:1)因颅内动脉瘤破裂导致SAH的个体;2)年龄在20至70岁之间的个体,不分性别和种族;3)自愿参与并提供知情同意的个体,可亲自或通过可信家庭成员提供;4)在动脉瘤破裂后72小时内接受干预的个体。另一方面,排除标准包括:1)不符合纳入标准或被医生认为不适合参加的个体;2)有严重心脏、肝/肾或肺功能不全的个体;3)有大颅内血肿的个体;4)接受开颅手术封闭动脉瘤的个体;5)拒绝随机分组的个体。参与者随机分配到氢气干预组或常规治疗组。氢气干预组的患者从入院到出院每天吸入氢气(NB-X71A,上海纳米气泡科技有限公司)18-24小时,流量为350 ml/min。脑脊液(CSF)在SAH后的第1-3天、第5-7天和第8-10天通过腰穿收集。
死亡率
动物实验的图表显示在图S1B中。假手术组没有小鼠死亡。本研究包括两个实验。对于实验1,小鼠在SAH后接受氢气治疗。获取组织进行生化测试的时间是SAH后3天。SAH组的死亡率为22.86%(12/54)。SAH + H2组的死亡率为19.23%(10/52)。对于实验2,小鼠在SAH后接受氢气治疗。
在体内实验中,小鼠被安置在含有3%氢气浓度的小室内。进行不间断的氢气吸入,实验研究的终点是SAH后的第三天。使用氢气发生器和空气发生器连续输出3%的氢气。在体外实验中,细胞经过孵育过程,放置在培养箱(PH-min,无锡普和生物医药科技有限公司)中,其组成为60%氢气、5%二氧化碳和30%氧气,同时保持37°C的温度和控制湿度。在对照组中,细胞在相同的孵育条件下接受处理,二氧化碳和氧气的浓度相同,湿度和温度水平也相当。
临床患者数据
氢气吸入抑制了SAH参与者中的铁死亡和炎症反应。本研究调查了CSF因子。图9A显示,氢气干预组与传统治疗组之间的MDA存在显著差异,前者在8-10天时的MDA水平较低。TNF-α和IL-6的观察结果相似,如图9B和9C所示。IL-1β显示出更早的暴露差异,氢气干预组在5-7天和8-10天的CSF水平低于传统治疗组(图9D)。
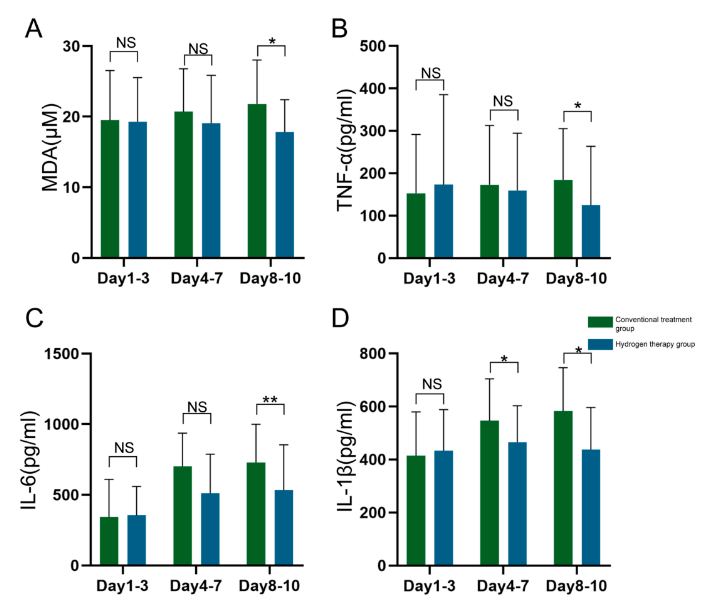
图9 在氢气吸入治疗的患者(n=23)与传统治疗的患者(n=26)中,不同时间点脑脊液中的MDA(图A)、TNF-α(图B)、IL-6(图C)和IL-1β(图D)的差异。
讨论
铁死亡是一种程序化的神经元死亡形式,发生在蛛网膜下腔出血(SAH)之后[32]。SAH 导致脑脊液中血细胞溶解释放出过量的铁离子,从而扰乱神经系统内的铁稳态。这种紊乱导致铁过载和随后的神经元铁死亡[33,34]。
在诱导细胞氧化应激的各种因素中,脂质双层中的脂质氧化修饰,尤其是脂质过氧化,已成为细胞命运的重要调节因子[35]。在生物体内,自由基诱导的脂质过氧化最终产物是丙二醛(MDA)[36]。MDA 作为评估生物体脂质过氧化的重要生物标志物,影响线粒体呼吸链复合体和线粒体内关键酶活性,并进一步加剧膜结构损伤[37]。GPX4 是一种内源性调节蛋白,通过限制细胞毒性脂质过氧化和通过将还原型谷胱甘肽转化为氧化型谷胱甘肽来对抗铁死亡,对保护细胞免受铁沉积起着至关重要的作用[7, 38, 39]。由于广泛的脂质过氧化诱导的谷胱甘肽耗竭,GPX4 的失活发生,这是铁死亡的一个显著特征[40]。GPX4 的缺失允许磷脂过氧化物在铁离子存在下启动催化反应,导致细胞死亡[35]。
结论
以前的研究已经证实了氢气在 SAH 情况下的神经保护特性。在本研究中,我们旨在阐明这种保护作用的潜在机制。我们的调查显示,氢气在 SAH 后展现了双重保护效应,它促进了 Nrf2 向核内的转移,激活了 GPX4,并抑制了 TLR4。因此,这种抑制减轻了神经元铁死亡并减弱了神经炎症。我们的研究结果为氢气的未来临床应用提供了理论框架。
Z. Peng, X.-J. Li, Y. Zhou, J.-T. Zhang, Q. Zhu, J.-Q. Sun, C.-H. Hang, W. Li,Q.-R. Zhang, Z. Zhuang, Hydrogen exerts neuroprotective effects after subarachnoid hemorrhage by attenuating neuronal ferroptosis and inhibiting neuroinflammation, Free Radical Biology and Medicine (2024),







