氢气健康学——氢对免疫力的调节作用
研究发现,分子氢可恢复耗耗竭的细胞毒性T细胞,消除机体免疫抑制状态,从而维持体内免疫平衡。Akaji(2019)报道了55例IV期大肠癌患者接受氢氧吸入治疗,每天3小时,持续3个月。结果发现,氢气减少了衰竭端PD1+ 和PD1 CD8+ T细胞的丰度,增加了活性端PD1 CD8+ T细胞的丰度,改善了无进展生存期(PFS)和总体生存期(OS),这表明,氢气可以通过降低末端PD-1+ CD8+ T细胞的比例来恢复末端PD1+ 与PD1 CD8+ T细胞之间的平衡。 徐克成团队(Chen 2020)对20名晚期肺癌患者进行了氢氧混合气体(67%氢气和33%氧气)吸入治疗,每天4小时,持续2周,发现患者在吸入混合气体后,体内的几乎所有功能性免疫细胞,包括Tc细胞、Th细胞以及自然杀伤(NK)细胞和γδT细胞均有增加,而多个衰老或衰竭的细胞亚群减少(图2.10),此外,患者血液中的Treg细胞减少。
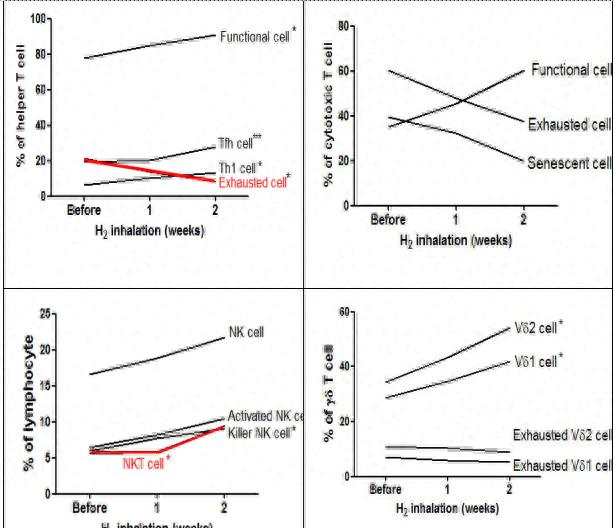
图2.10 吸氢(67%H2和33%O2)前后免疫细胞的变化(引自 Chen 2020)
有证据表明,氢对免疫力的调节作用可能主要体现在对耗竭T细胞的拯救 (,2018)。 T细胞耗竭是T细胞功能障碍的一种状态,出现在许多病毒感染和癌症中( ,2007)。在急性感染中,原始T细胞被激活并分化为效应T细胞。这种分化伴随着效应T细胞的基本特性的获取,如效应功能、变异的组织归巢和急剧的数量扩张。在效应物扩张和抗原清除的高峰之后,大多数活化的T细胞死亡,但一小部分亚组持续存在并转变为记忆T细胞,这些细胞通过不依赖抗原的自我更新,能快速重新激活效应物。如果感染继续转变为慢性感染,记忆T细胞分化程序会明显改变,形成变异的分化状态,称为T细胞耗竭,伴有渐进和分级的效应物功能丧失、代谢紊乱、无法过渡到静止状态并获取非抗原依赖性记忆T细胞稳态。 T细胞耗竭会阻碍感染的最佳控制,诱发某些抑制性受体的耗竭过度表达,如程序性细胞死亡蛋白1(PD-1)和细胞毒性T淋巴细胞抗原4(CTLA4)(图2.11)。
简而言之,耗竭T细胞具有以下特征:①过度表达的抑制性受体,包括PD-1;②(2)T细胞受体和细胞因子信号通路的重大变化;③显示出与趋化性、粘附和迁移相关的基因表达变化;④表达一组独特的转录因子;⑤严重的代谢和生物能缺陷。 T细胞耗竭是渐进性的,基因表达谱表明T细胞耗竭与无效能是不同的过程。 研究显示,功能性耗竭可能是信号传导和新陈代谢的主动抑制和被动缺陷 (,2011; ,2014; ,2018)。
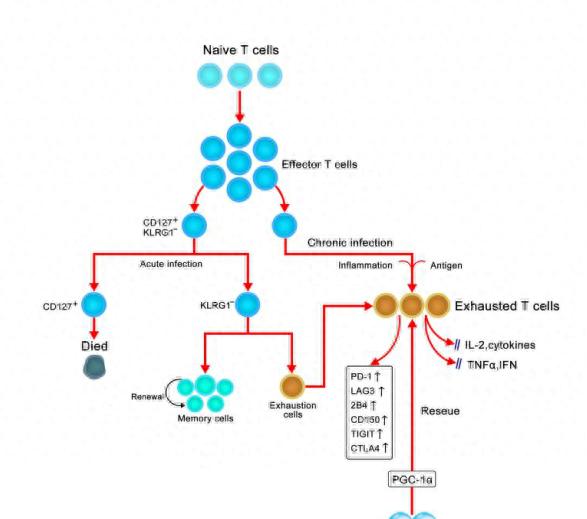
图2.11 病毒感染后T细胞耗竭的发展
感染后,初始T细胞被抗原和炎症激活,增殖形成效应细胞群。大多数表达杀伤细胞凝集素样受体亚家族G成员1(KLRG1)的效应CD8+ T细胞在收缩期死亡,而保留了CD127表达的效应CD8+ T细胞群,这些细胞可以转化为记忆或耗竭性CD8+ T细胞。通过清除抗原和/或炎症,效应CD8+ T细胞进一步分化为功能性记忆CD8+ T细胞,可产生多种细胞因子,如干扰素-γ(IFNγ)、肿瘤坏死因子(TNF)和白介素-2(IL-2)。在慢性感染期间,感染进展,T细胞持续受到刺激,逐渐分层失去效应物功能,进而衰竭,产生IL-2、高增殖能力等功能会提前丧失,随之出现IFNγ和TNF生成的缺陷。T细胞耗竭还伴有抑制性受体表达数量和多样性的逐步增加,包括程序性细胞死亡蛋白1(PD1)、淋巴细胞激活基因3蛋白(LAG3)、2B4、CD160、带有免疫球蛋白和ITIM结构域(TIGIT)的T细胞免疫受体,以及细胞毒性T淋巴细胞抗原4(CTLA4)。最终,如果感染严重或持续时间长,特异性T细胞会丢失(“删除”)。氢气可增加过氧化物酶体增殖物激活受体γ共激活因子1α(PGC-1α)的基因表达,逆转耗竭状态,恢复最佳的保护性免疫反应。(参考自 2014)
扭转耗竭状态和恢复最佳保护性免疫应答在临床实践中具有重要意义[, 2017; ,2011; , 2018]。众所周知,线粒体在调节先天和适应性免疫中,对于激活T细胞必不可少。 当T细胞受体(TCR)与组织相容性复合物(MHC)结合时,众多信号级联被激活。合成代谢程序被激活,增加葡萄糖和谷氨酰胺的吸收,以满足增殖和诱发适应性免疫应答的新陈代谢需求。 效应T细胞中的线粒体发挥合成代谢枢纽的作用。 同时,记忆T细胞利用脂肪酸的分解代谢来产生三磷酸腺苷(ATP),从而促进细胞存活[,2015; ,2016]。
业已表明,线粒体的能量代谢依赖于转录辅激活因子过氧化物酶体增殖物激活受体γ辅激活因子(PGC-1α)、成纤维细胞生长因子21(FGF21)和氧化物酶体增殖物激活受体α(PPARα)的活性,这些辅激活因子是线粒体的重要调控因子。 PGC-1α通过激活各种转录因子在调节细胞能量代谢中起着核心作用。当PGC-1α激活转录因子PPARα时,脂肪酸代谢增强。PPAR作为配体激活的转录因子,均受到PGC-1α的转录共激活。 PPARα调控与脂肪酸β-氧化有关的基因的表达。 FGF21刺激成纤维细胞生长因子受体底物2和细胞外信号调节蛋白激酶1和2(ERK1 / 2)的磷酸化,从而诱发肝脏中糖异生、脂质代谢和酮生成的关键调控因子的表达[,2015] 。这些关键因子之间的相互作用非常复杂:FGF21依赖PPARα转录PGC-1α,而FGF21诱发PGC-1α。
实验证明,分子氢在早期增加了PGC-1α的基因表达。 因此,PGC-1α激活PPARα,PPARα转录FGF21基因,参与脂肪酸和类固醇代谢。 总之,PGC1α是信号整合的关键节点,它将各种细胞信号与线粒体的生物发生和T细胞生物学联系起来[, 2016]。
此外,H2能还原羟基自由基(•OH),而后者是自由基链式反应的触发器,因此,氢通过阻止自由基链式反应,减少过氧化物及其最终产物[ 2016]。
另外,辅酶Q10也可能与H2的免疫调节有关。 Akagi [2019]发现,72%接受氢疗法的患者血液Co Q10水平升高。 Co Q10是线粒体呼吸链中必不可少的电子载体,它能将复合物I和II中的电子转移到复合物III中,催化分子氢和•OH的结合形成水(H2O),中和•OH,减少•OH对线粒体的损害 [Xu 2020]。
需要指出的是,免疫细胞的衰老集中在单个淋巴细胞的表型特征上,其功能不一定在衰老过程中下降。与耗竭不同,衰老的免疫细胞不一定会逐渐降低所有免疫功能,而是一个高度动态的重塑和适应过程[Fulop 2010; Akagi 和Baba 2019)。 氢在这一适应过程中发挥调节作用。







